MolPure® Magnetic Residual DNA Sample Preparation Kit 磁珠法残留DNA样本前处理试剂盒(瓶装)
产品介绍
MolPure® Magnetic Residual DNA Sample Preparation Kit适用于生物制品样本中残留DNA检测的前处理。采用独特的磁珠和精心优化的缓冲体系,可最大限度的分离纯化样本中的微量宿主细胞残留DNA。该前处理试剂盒可与本公司的多种宿主细胞DNA残留(qPCR法)检测试剂盒配合使用,包括CHO宿主细胞残留DNA检测试剂盒(Cat#41301ES)、HEK293宿主细胞残留DNA检测试剂盒(Cat#41302ES)、Vero宿主细胞残留DNA检测试剂盒(Cat#41303ES)和E.coli残留DNA检测试剂盒(Cat#41304ES)。
产品特色
- 符合法规:按照Chp、USP、ICHQ2(R2)等要求进行全面验证;
- 保障品质:试剂盒所需酶原料全自产,且已产业化,供货稳定;
- 配合审计:生产工艺稳定,批间差可控,有完善的审计文件;
- 回收率高:宿主残留DNA回收率达到70%~130%;
- 提取纯度高:所提取的 DNA 样品无蛋白、盐类及活性剂等污染;
- 抽提形式多样:手工和预装板2种形式,适配不同的样本量需求(可高通量提取);
- 兼容性好:下游可配套其他厂家的检测试剂盒使用。
应用案例
1、样本提取回收效率
以E.coli残留DNA检测试剂盒(Cat#41304ES)为例,在标曲范围内各浓度DNA采用该磁珠法残留DNA样本前处理试剂盒(瓶装)进行提取,提取后样本的回收率满足70~~130%范围内,且CV<10%。
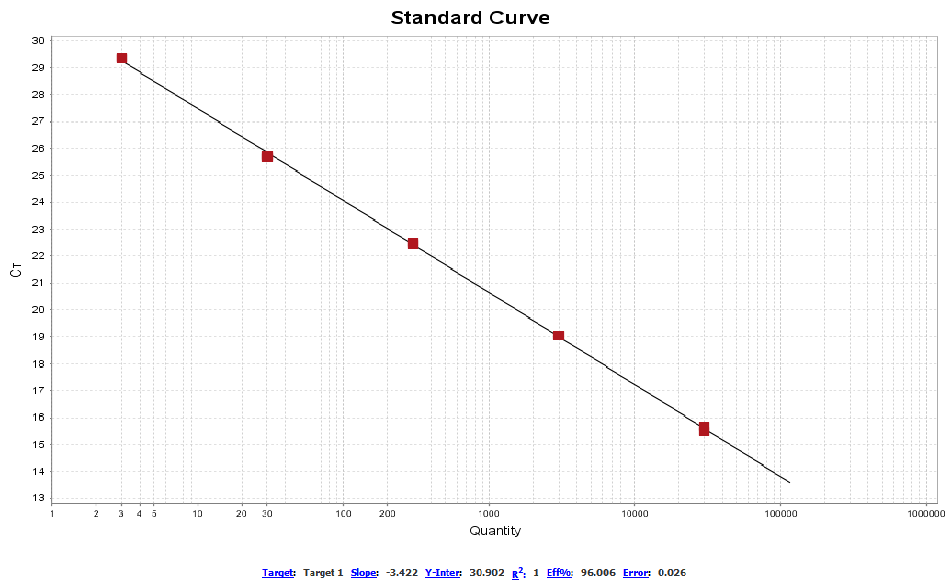
图1. E.coli DNA标曲线性图
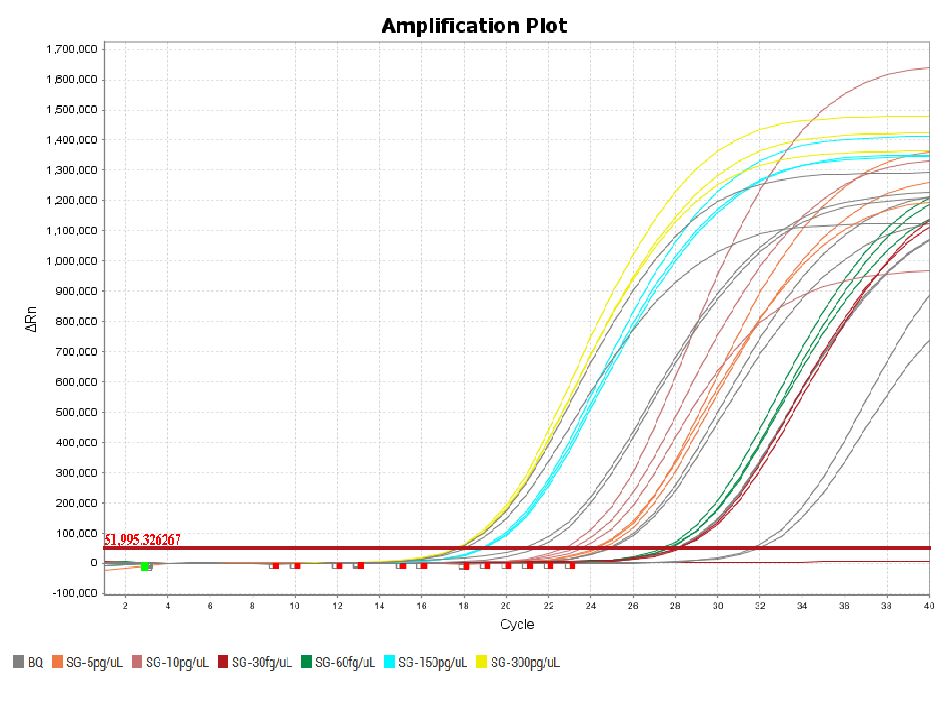
图2. E.coli DNA标曲范围内各浓度DNA扩增曲线线性图
存储条件
1. Part I组分冰袋运输,4℃可保存1年,长期保存于-20℃。
2. Part II组分室温运输,室温保存,有效期1年。
3. Part Ⅲ组分干冰运输,-20℃保存1年。
4. 收到货后,请检查Part I、Part II和Part Ⅲ共3个组分是否齐全,并立即放入对应的保存温度中储存。
COA
相关产品
联系我们





