Vero Host Cell DNA Residue Detection Kit (2G) Vero宿主细胞DNA残留检测试剂盒(2G)
产品介绍
Vero宿主细胞DNA残留检测试剂盒是用于定量分析检测各种生物制品的中间品、半成品和成品中的Vero残留DNA含量的试剂盒。本试剂盒采用探针法荧光定量PCR原理,可专一快速的检测Vero细胞的残留DNA,其最低检测限可以达到fg水平。该试剂盒可与本公司的磁珠法残留DNA样本前处理试剂盒(Cat#18461ES/18462ES)配套使用。
产品特色
- 抗干扰性:针对复杂基质,样本加标回收率至少能达到70~130%;
- 灵敏度高:定量下限(LLOQ)为0.5 fg/μL;
- 精密度高:批内重复性高CV<10%,批间差异小即中间精密度CV<15%;
- 专属性强:特异性检测Vero残留DNA,不受其他外源基因组DNA干扰;
- 防干扰强:引入内部质控(IC),可排除样本干扰、反应配制异常等因素,有效避免假阴性。
- 验证完善:参考ICH Q2(R2)分析方法验证指导原则,可提供完善的验证报告;
- 符合法规:按照EP2.6.7、JP G3和USP 63药典要求验证,符合国际权威机构的标准;
- 保障品质:试剂盒所需酶原料全自产,且已产业化,供货稳定。
应用案例
1. 检测范围
Vero DNA线性范围为:3fg/μL~300pg/μL,R2=0.999,扩增效率为95.6%,各浓度检测值CV<15%。
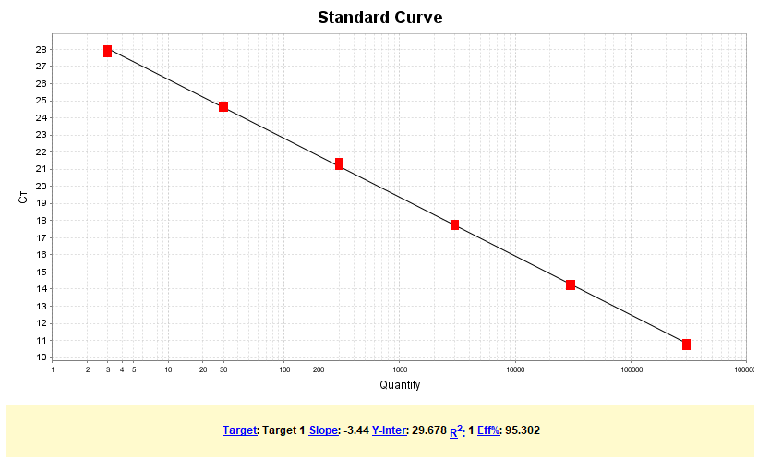
图1. Vero DNA标曲线性图

图2. 扩增曲线线性图
存储条件
1. 所有组分均干冰运输,-25~-15℃保存,有效期2年。其中,41307-A和41307-B均需避光保存。
2. 收到货后,请检查共5个组分是否齐全,并立即放入对应的保存温度中储存。
COA
相关产品
联系我们





