Vero宿主细胞残留DNA片段分析试剂盒是用于定量分析检测各种生物制品的中间品、半成品和成品中不同长度的Vero残留DNA含量的试剂盒。本试剂盒采用qPCR荧光探针原理,专一快速的检测200bp以下及以上的VeroDNA残留,其定量限可以达到3fg/μL水平,且配套有VeroDNAControl(DNA定量参考品)。该试剂盒可与本公司的磁珠法残留DNA样本前处理试剂盒(Cat#18461ES/18462ES)配套使用。
- 符合法规:按照Chp、USP、ICH等要求进行全面验证,性能符合中外法规标准;
- 保障品质:试剂盒原材料全自主研发,qPCR Mix等酶产品在超洁净酶工厂生产;
- 配合审计:保障试剂盒生产工艺稳定,批间差可控,有完善的审计文件;
- 抗干扰性:针对复杂基质,样本加标回收率至少能达到70~130%;
- 灵敏度高:定量下限(LLOQ)为3 fg/μL;
- 精密度高:批内重复性高CV<10%,批间差异小即中间精密度CV<15%;
- 专属性强:特异性检测Vero细胞残留DNA,不受其他外源基因组DNA干扰;
- 防干扰强:引入内部质控(IC),可排除样本干扰、反应配制异常等因素,有效避免假阴性。
1. 检测范围
该试剂盒含有四种不同长度的扩增片段:97bp、154bp、219bp、507bp,需分别针对这四个片段设置标曲。四片段线性范围均为30 fg/μL~300 pg/μL,R2>0.99,扩增效率在90%~110%之间,各浓度检测值CV<15%。
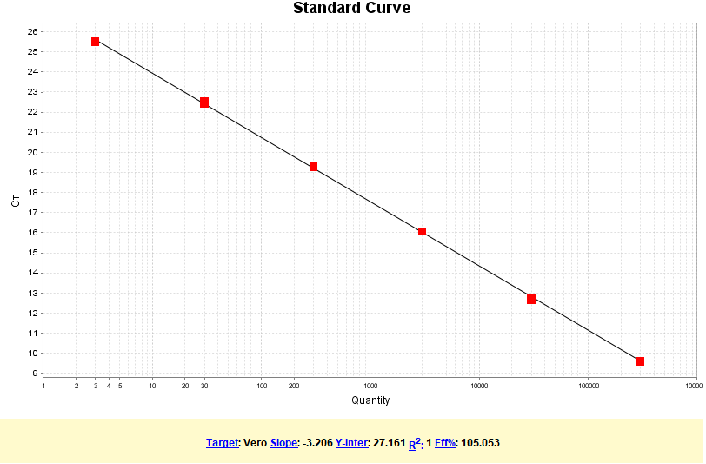
图1. 97bp扩增片段标曲线性图
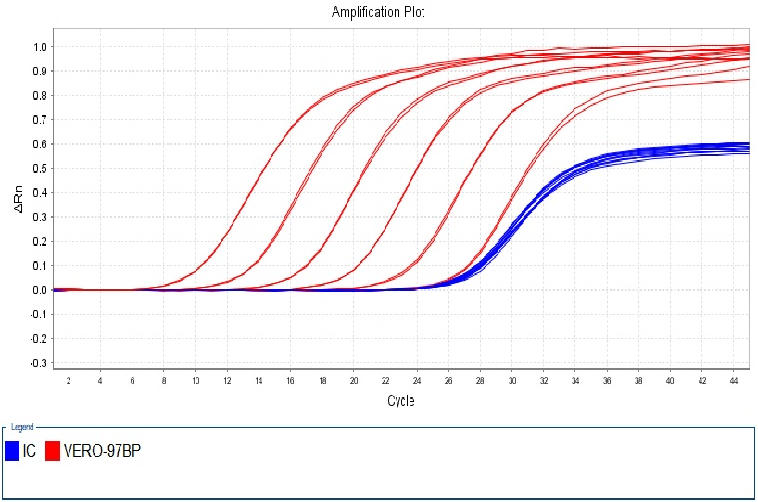
图2. 97bp扩增片段扩增曲线线性图谱
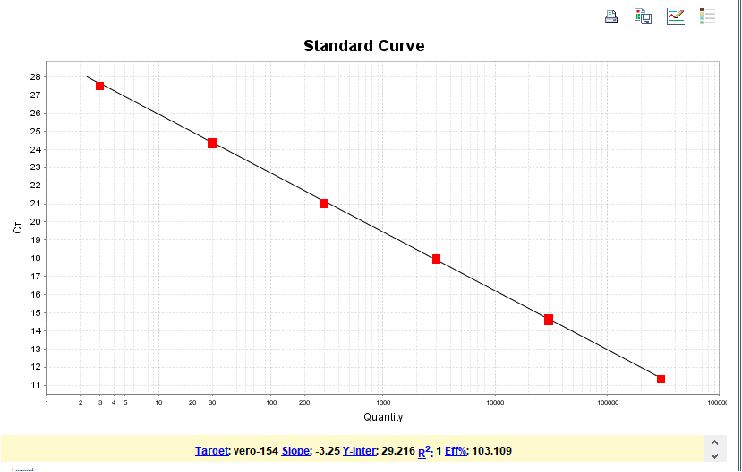
图3. 154bp扩增片段标曲线性图
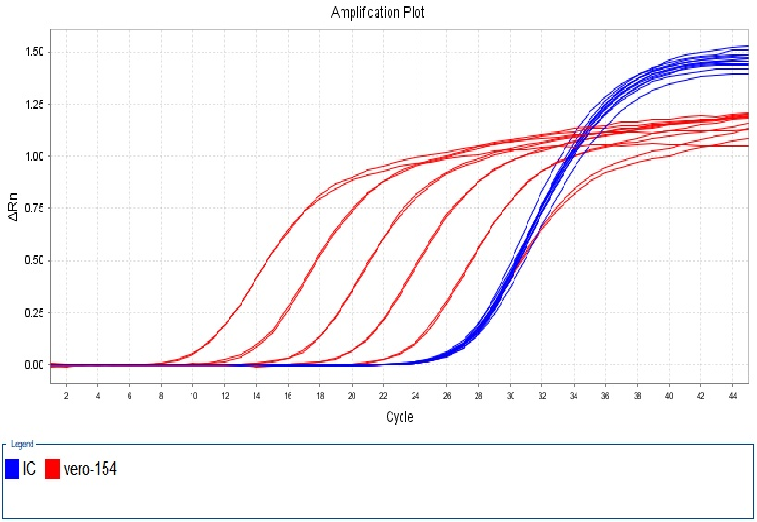
图4. 154bp扩增曲线线性图谱
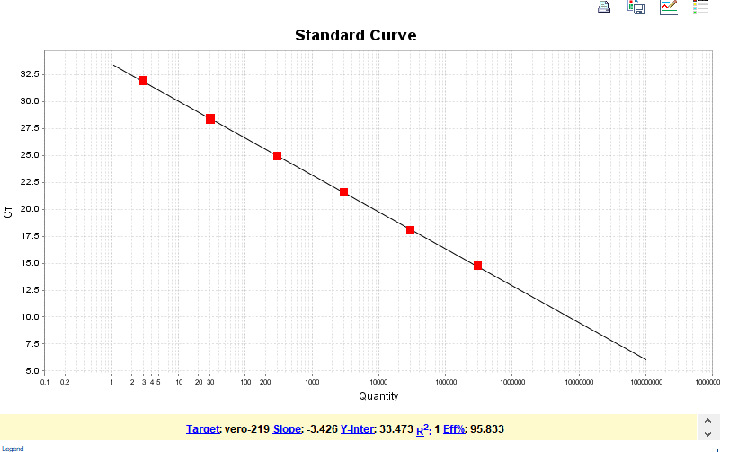
图5. 219bp扩增片段标曲线性图
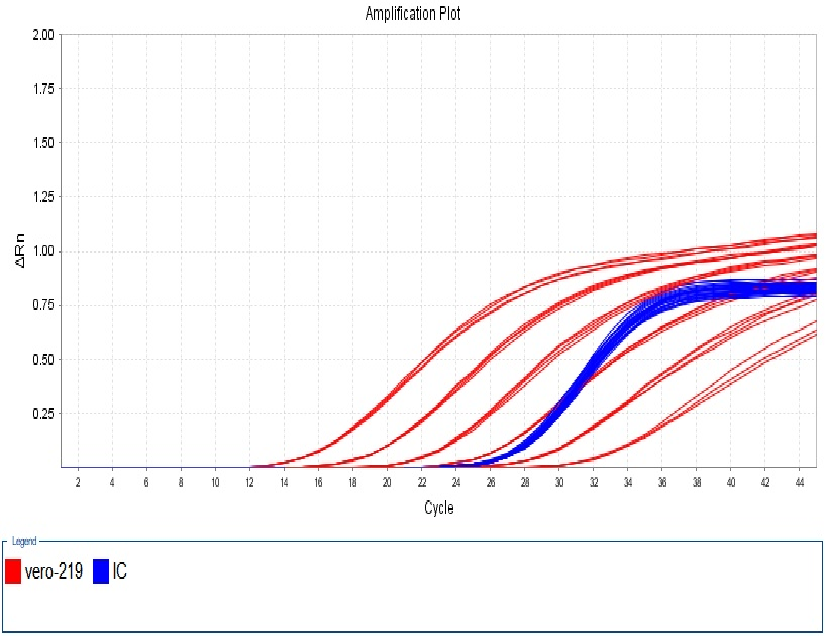
图6. 219bp扩增曲线线性图谱
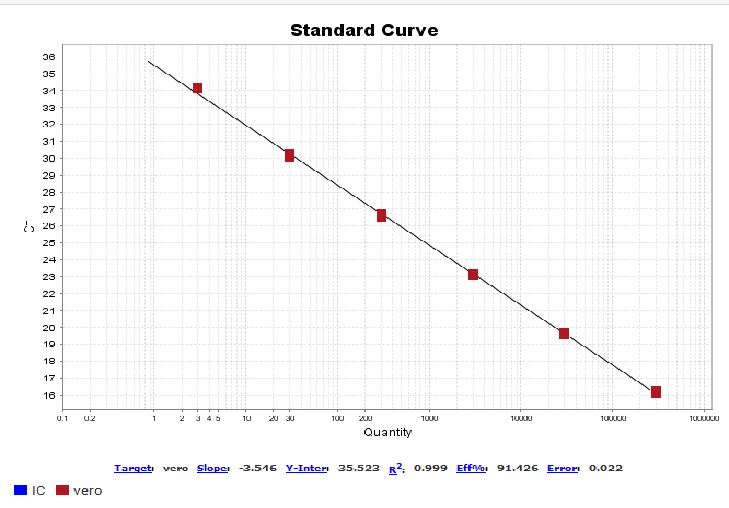
图7. 507bp扩增片段标曲线性图
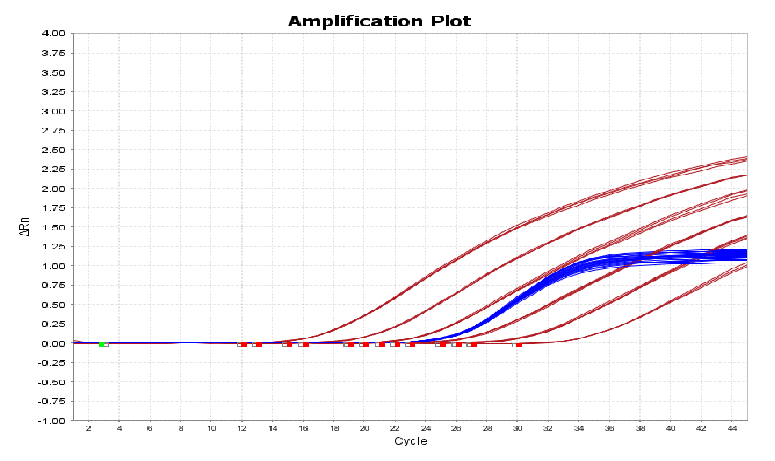
图8. 507bp扩增曲线线性图谱(下)
1. 所有组分均干冰运输,-25~-15℃保存,有效期2年。其中A组分和B1、B2、B3、B4组分均需避光保存。
2. 收到货后,请检查共8个组分是否齐全,并立即放入对应的保存温度中储存。





