Hifair® Advanced One Step RT-qPCR SYBR Green Kit是一款基于SYBR Green I染料进行荧光定量的试剂盒。使用基因特异性引物,反转录和qPCR反应在一管内完成,无需反复的开盖和移液操作,大大提高了检测效率,并降低了污染的风险。对于RNA样本,试剂盒采用耐热Hifair® V Reverse Transcriptase高效合成cDNA,同时采用UNICON® HotStart Taq DNA Polymerase进行定量扩增。在优化的缓冲体系下,该试剂盒的检测灵敏度针对高表达的靶标, 可以检至0.1 pg,中等表达的靶标,可以检至1 pg。该试剂盒同时也适用于DNA样本的扩增定量。该试剂盒可实现不同动植物样本、细胞、微生物核酸的高灵敏检测和定量。
产品组分
| 组分编号 | 组分名称 | 11175ES20 | 11175ES70 |
|---|---|---|---|
| 11175-A | 2× Hifair® Advanced SG Buffer | 250 μL | 2×1.25 mL |
| 11175-B | Hifair® Advanced UH Enzyme Mix | 20 μL | 200 μL |
| 11175-C | RNase free H2O | 250 μL | 2×1.25 mL |
- 全仪器平台通用:适用于国内外常见荧光定量仪器
- 灵敏度高:针对RNA样本,灵敏度高达0.1 pg;针对DNA样本,灵敏度高至单拷贝
- 重复性好: 高、中、低模板下90复孔间差异小
- 精准度好:可精确分辨2倍浓度差异的RNA或DNA模板
- 稳定性好:预混体系可于4℃条件下放置24小时,性能不发生变化
- 全仪器平台通用
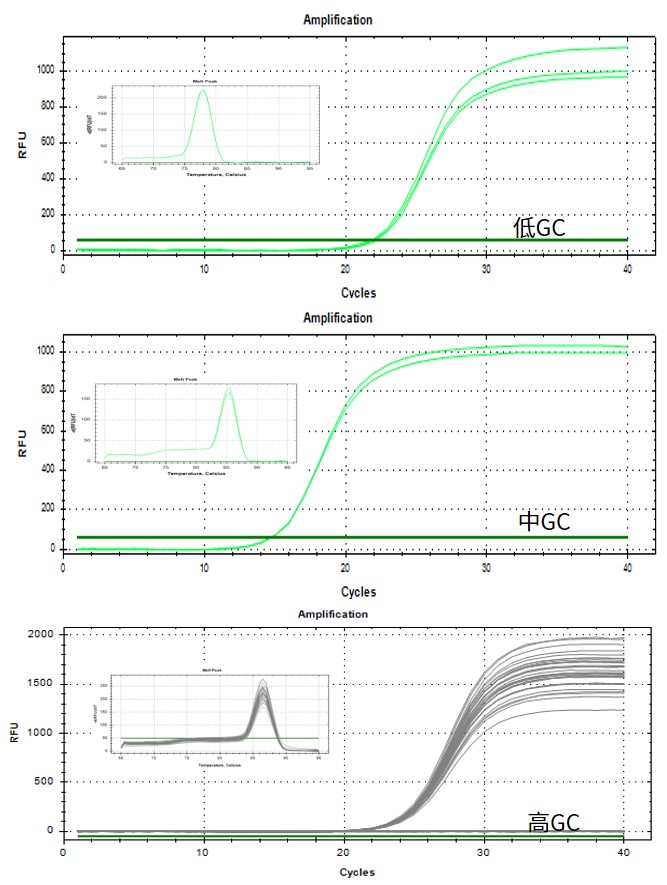
No Rox平台
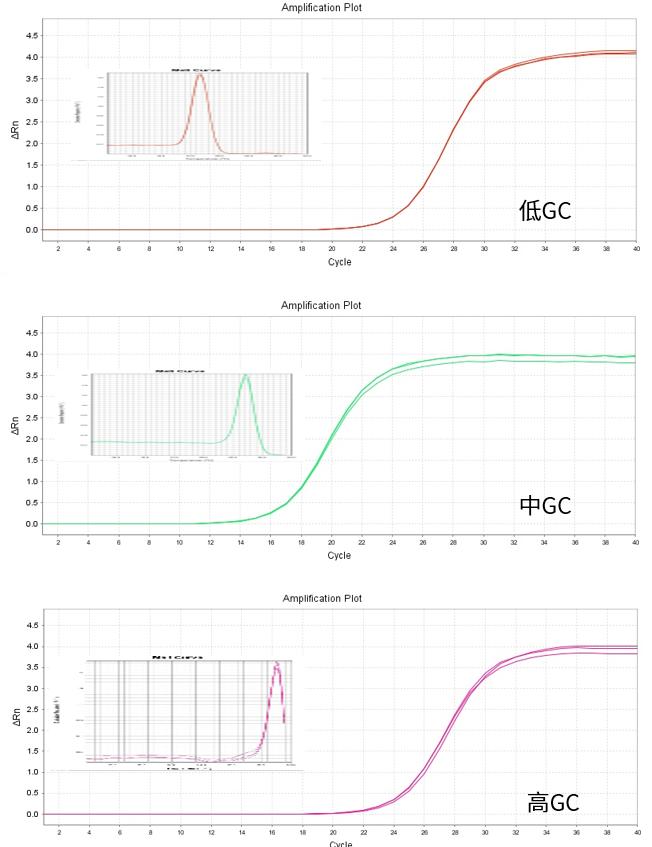
Low Rox平台
High Rox平台
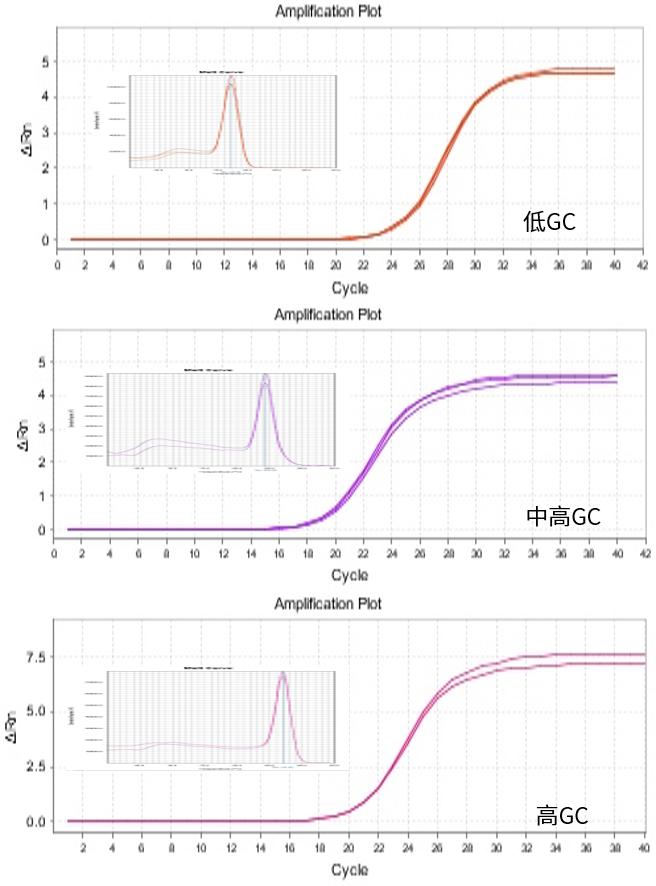
图.以293T细胞总RNA作为模板,分别在不同ROX类型机型上扩增不同GC含量的靶标。结果显示均可有效扩增,且熔解峰单一。
- 灵敏度高
RNA模板检测
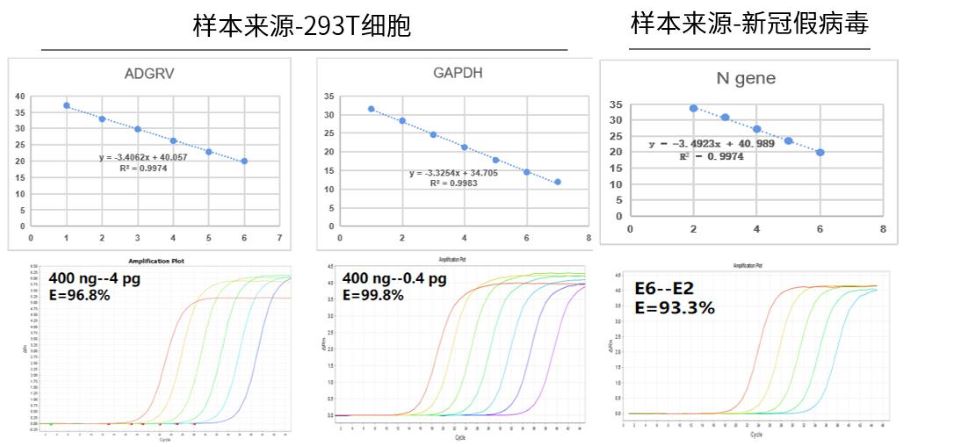
图.以RNA模板进行测试时,对于高表达的靶标,可以检测至0.1pg级别,中等表达的靶标,可以检测至1pg级别;病毒类可以检测至E2。
DNA模板检测
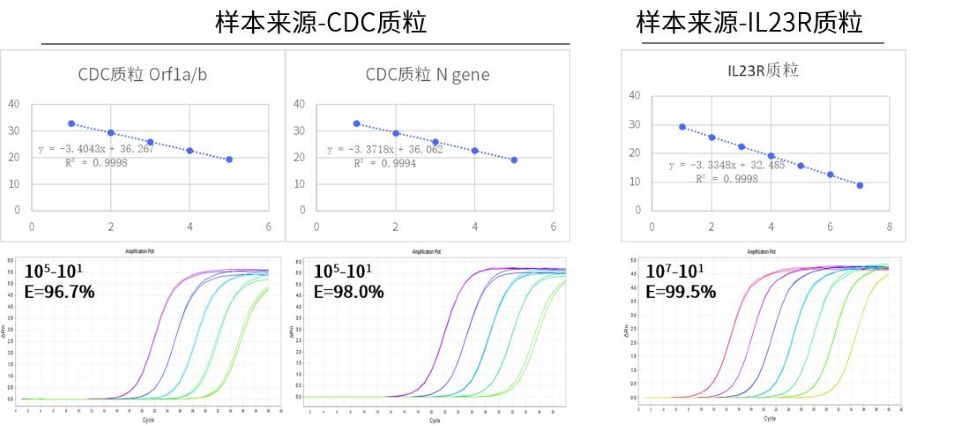
图.以DNA样本进行测试时,可在轻松检测十位数拷贝以上的基因。另外针对以上样本的单拷贝检测,也可出现扩增信号。
- 灵敏度性能比对
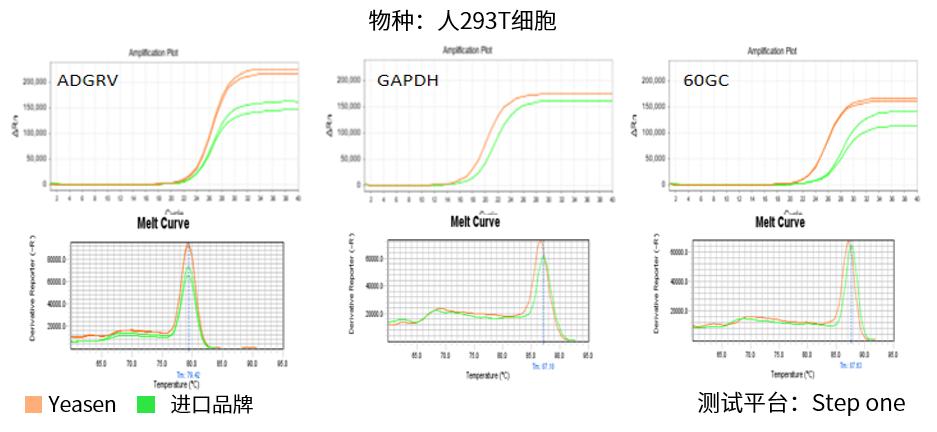
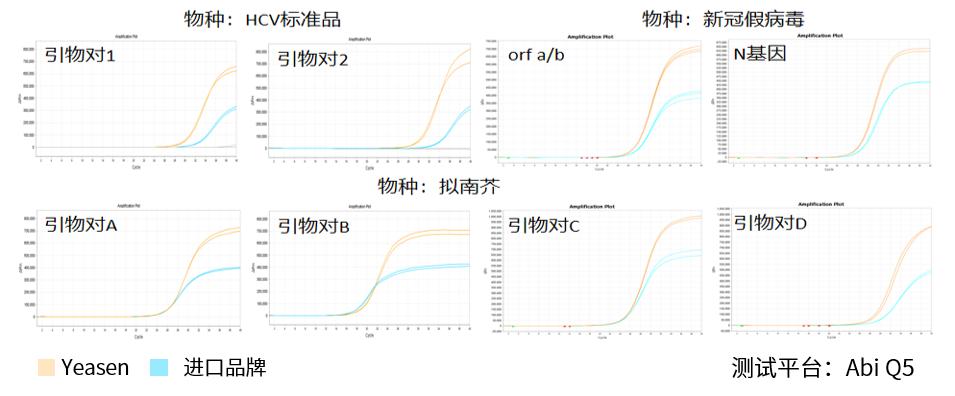
图.分别以人293T细胞、HCV、新冠假病毒、拟南芥来源的RNA作为模板在不同的仪器上进行测试,结果显示,相较于进口品牌,翌圣的11175ES的灵敏度更好,荧光平台期更高。
- 精准度好

图.以293T细胞RNA为模板,2倍形式梯度稀释模板,以11175ES进行检测。结果显示,11175ES可以精确分辨2倍的浓度模板差异。
- 稳定性好
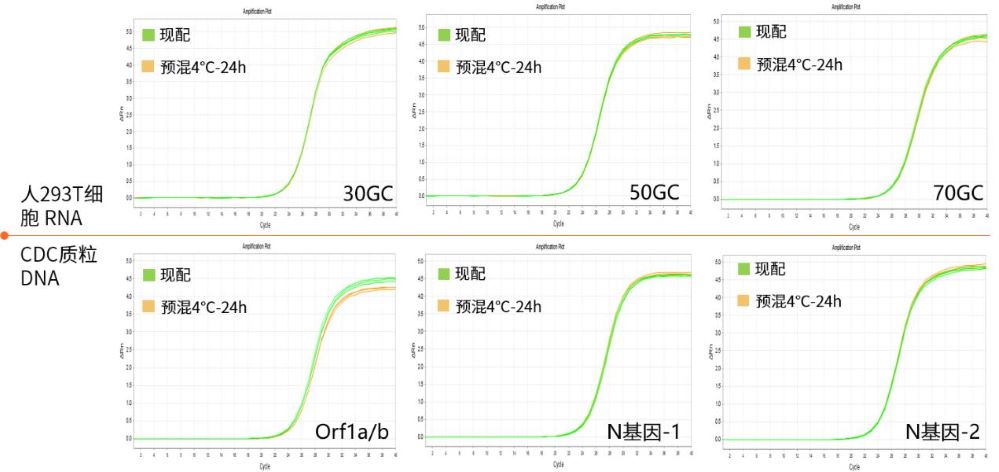
图.分别检测两种不同类型的模板,先加入引物、试剂、水等进行预混,在4℃条件下放置24小时后,再加入模板上机。结果显示,0时刻现配体系和体系预混24小时后的差别小,体系稳定性高。
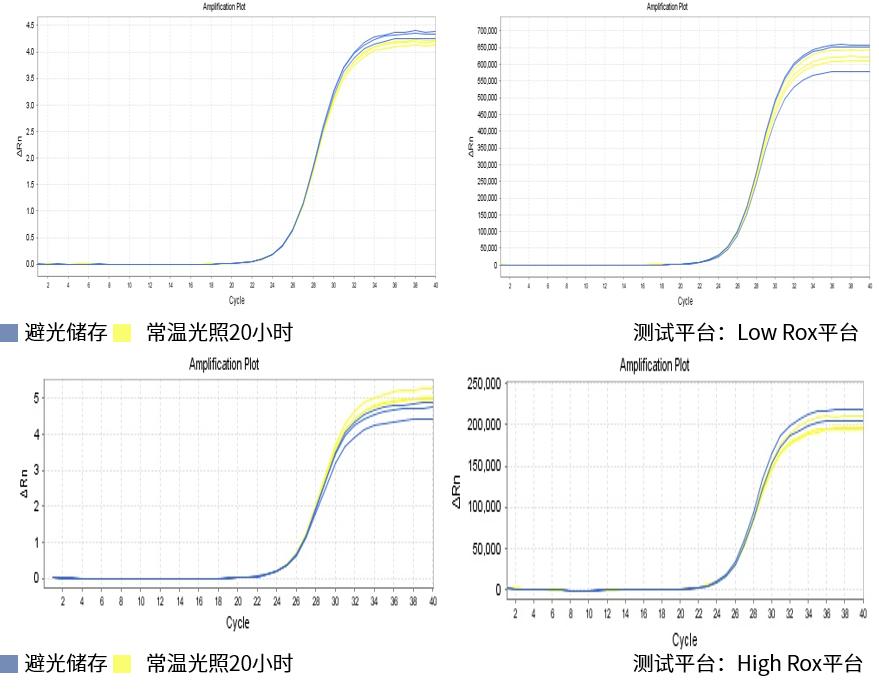
图.将试剂置于超净台常温光照20小时后进行三对引物测试,结果显示,正常避光储存和常温光照20小时的试剂之间没有明显差异,体系稳定性好。
-25~-15℃避光储存,有效期1年。





