Hieff UNICON® Universal Blue qPCR SYBR Green Master Mix是2×实时定量PCR扩增的预溶液,具有高灵敏度和高特异性的特点,颜色为蓝色,具有加样示踪的作用。核心组分Hieff UNICON® Taq DNA聚合酶采用抗体法热启动,可以有效抑制样品准备过程中引物退火导致的非特异性扩增。同时配方添加了提升PCR反应扩增效率因子和均衡不同GC含量(30~70%)基因扩增的促进因子,使定量PCR可以在宽广的定量区域内获得良好的线性关系。
本产品中含有特殊的ROX Passive Reference Dye,适用于所有qPCR仪器,无需在不同的仪器上调整ROX的浓度,只需在配制反应体系时加入引物和模板即可进行扩增。
- 全仪器平台通用:预混特定类型参比染料,无需调整ROX浓度
- 易于示踪:蓝色预混液,观察颜色可直接区分是否加样
- 强稳定性:室温配制体系,配制后的体系可4℃放置24 h,检测结果无变化
- 上机快速:兼容常规程序与快速程序,最快46 min完成定量实验
- 扩增性能好:扩增效率高,特异性好,可检测个位拷贝数基因
- 全平台通用:适用于所有qPCR机型
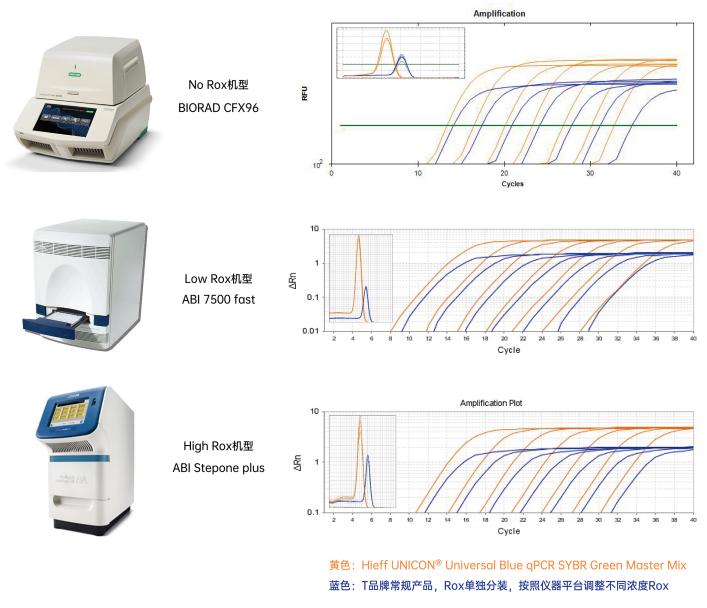
图1. Hieff UNICON® Universal Blue 预混液可实现全平台通用。针对不同仪器平台,与T品牌对比,Hieff UNICON® Universal Blue 预混液Ct值起峰更加靠前。以2 µL的质粒10倍梯度稀释液为模板,扩增IL23R基因。
- 灵敏度高:可检测至单拷贝
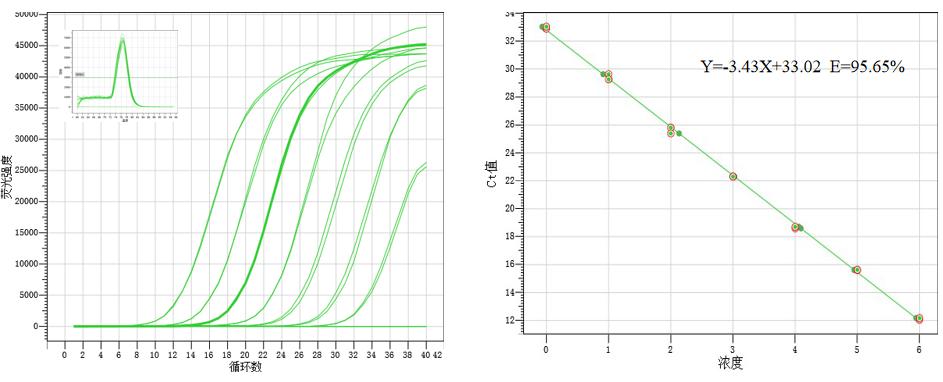
图2. Hieff UNICON® Universal Blue 预混液可有效检测7个数量级范围的模板量,扩增效率高,可在宽广的线性范围内获得良好的线性关系。以2 µL的106-100拷贝的质粒为模板,扩增人IL23R基因。
- 检出率和特异性良好:广泛适用于30-70%GC含量的扩增子
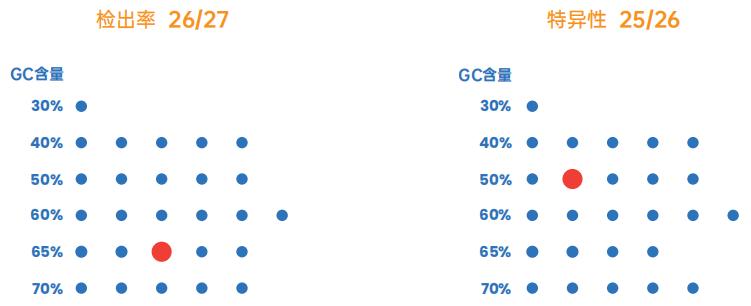
图3. Hieff UNICON® Universal Blue预混液广泛适用于30-70%GC含量的扩增子,保证了极高的特异性检出率。以2 µL的293T cDNA为模板,利用Primer5软件设计1000对长度为200 bp扩增子(GC%含量30%-70%)的引物,随机扩增其中的27个扩增子。
- 分辨率高:可精准分辨2倍模板浓度差异
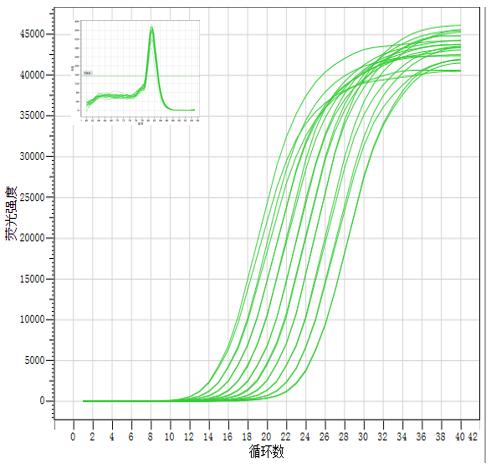
图4. Hieff UNICON® Universal Blue 预混液可精准区分2倍模板浓度差异。以2 µL的293T cDNA原液的2倍梯度稀释液为模板,扩增GAPDH基因。
- 复孔重复性好:90个复孔
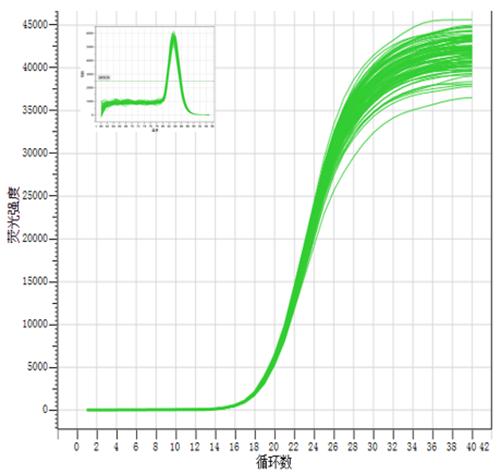
图5. Hieff UNICON® Universal Blue预混液具备良好的重复性,90个复孔的扩增曲线高度重合,Ct值标准偏差<0.2。以1 µL的293T cDNA为模板,扩增GAPDH基因。
冰袋运输。-20℃避光储存,有效期18个月。
本品避免反复冻融。产品中含有荧光染料SYBR Green I,保存或配制反应体系时需避免强光照射。
[1] Xia B, Shen X, He Y, et al. SARS-CoV-2 envelope protein causes acute respiratory distress syndrome (ARDS)-like pathological damages and constitutes an antiviral target. Cell Res. 2021;31(8):847-860. doi:10.1038/s41422-021-00519-4(IF:25.617)
[2] Wang S, Li Y, Zhong L, et al. Efficient gene editing through an intronic selection marker in cells. Cell Mol Life Sci. 2022;79(2):111. Published 2022 Jan 31. doi:10.1007/s00018-022-04152-1(IF:9.261)
[3] An LL, Zhao X, Gong XY, et al. Promoter Binding and Nuclear Retention Features of Zebrafish IRF Family Members in IFN Response. Front Immunol. 2022;13:861262. Published 2022 Apr 6. doi:10.3389/fimmu.2022.861262(IF:7.561)
[4] Zhao Y, Wang HP, Yu C, et al. Integration of physiological and metabolomic profiles to elucidate the regulatory mechanisms underlying the stimulatory effect of melatonin on astaxanthin and lipids coproduction in Haematococcus pluvialis under inductive stress conditions. Bioresour Technol. 2021;319:124150. doi:10.1016/j.biortech.2020.124150(IF:7.539)
[5] Shu C, Wang L, Zou C, et al. Function of Foxl2 and Dmrt1 proteins during gonadal differentiation in the olive flounder Paralichthys olivaceus [published online ahead of print, 2022 Jun 16]. Int J Biol Macromol. 2022;215:141-154. doi:10.1016/j.ijbiomac.2022.06.098(IF:6.953)
[6] Wang S, Huang J, Liu F, et al. Isosteviol Sodium Exerts Anti-Colitic Effects on BALB/c Mice with Dextran Sodium Sulfate-Induced Colitis Through Metabolic Reprogramming and Immune Response Modulation. J Inflamm Res. 2021;14:7107-7130. Published 2021 Dec 20. doi:10.2147/JIR.S344990(IF:6.922)
[7] Wang J, Hu R, Wang Z, et al. Establishment of Immortalized Yak Ruminal Epithelial Cell Lines by Lentivirus-Mediated SV40T and hTERT Gene Transduction. Oxid Med Cell Longev. 2022;2022:8128028. Published 2022 Mar 25. doi:10.1155/2022/8128028(IF:6.543)
[8] Liu W, Guan Y, Qiao S, et al. Antiaging Effects of Vicatia thibetica de Boiss Root Extract on Caenorhabditis elegans and Doxorubicin-Induced Premature Aging in Adult Mice. Oxid Med Cell Longev. 2021;2021:9942090. Published 2021 Aug 6. doi:10.1155/2021/9942090(IF:6.543)
[9] Qian Z, Liu C, Li H, et al. Osteocalcin Alleviates Lipopolysaccharide-Induced Acute Inflammation via Activation of GPR37 in Macrophages. Biomedicines. 2022;10(5):1006. Published 2022 Apr 27. doi:10.3390/biomedicines10051006(IF:6.081)
[10] Zhao X, Huang Y, Li X, et al. Full integration of nucleic acid extraction and detection into a centrifugal microfluidic chip employing chitosan-modified microspheres [published online ahead of print, 2022 Jun 27]. Talanta. 2022;250:123711. doi:10.1016/j.talanta.2022.123711(IF:6.057)
[11] Xu X, Wang H, Li X, Duan X, Wang Y. A novel ALG10/TGF-β positive regulatory loop contributes to the stemness of colorectal cancer. Aging (Albany NY). 2022;14(11):4858-4873. doi:10.18632/aging.204116(IF:5.955)
[12] Li F, Hu X, Wu J. Daidzein Activates Akt Pathway to Promote the Proliferation of Female Germline Stem Cells through Upregulating Clec11a [published online ahead of print, 2022 Jun 3]. Stem Cell Rev Rep. 2022;10.1007/s12015-022-10394-0. doi:10.1007/s12015-022-10394-0(IF:5.739)
[13] Ru M, Wang W, Zhai Z, et al. Nicotinamide mononucleotide supplementation protects the intestinal function in aging mice and D-galactose induced senescent cells. Food Funct. 2022;13(14):7507-7519. Published 2022 Jul 18. doi:10.1039/d2fo00525e(IF:5.396)
[14] Ye M, Gao R, Chen S, et al. Downregulation of MEG3 and upregulation of EZH2 cooperatively promote neuroblastoma progression. J Cell Mol Med. 2022;26(8):2377-2391. doi:10.1111/jcmm.17258(IF:5.310)
[15] Wang S, Wang X, Shao Y, et al. Synthesis and evaluation of 3-(phenylethynyl)-1,1'-biphenyl-2-carboxylate derivatives as new HIF-1 inhibitors. Bioorg Chem. 2021;116:105298. doi:10.1016/j.bioorg.2021.105298(IF:5.275)
[16] Guan X, Meng X, Zhu K, et al. MYSM1 induces apoptosis and sensitizes TNBC cells to cisplatin via RSK3-phospho-BAD pathway. Cell Death Discov. 2022;8(1):84. Published 2022 Feb 26. doi:10.1038/s41420-022-00881-1(IF:5.241)
[17] Liu H, Wang LL, Xu QH, et al. UHRF1 shapes both the trophoblast invasion and decidual macrophage differentiation in early pregnancy. FASEB J. 2022;36(4):e22247. doi:10.1096/fj.202101647RR(IF:5.192)
[18] Chen M, Wang J, Lin L, et al. Synergistic Regulation of Metabolism by Ca2+/Reactive Oxygen Species in Penicillium brevicompactum Improves Production of Mycophenolic Acid and Investigation of the Ca2+ Channel [published correction appears in ACS Synth Biol. 2022 Apr 15;11(4):1705]. ACS Synth Biol. 2022;11(1):273-285. doi:10.1021/acssynbio.1c00413(IF:5.110)
[19] Zhao X , Li X , Yang W , Peng J , Huang J , Mi S . An integrated microfluidic detection system for the automated and rapid diagnosis of high-risk human papillomavirus. Analyst. 2021;146(16):5102-5114. doi:10.1039/d1an00623a(IF:4.616)
[20] Chen H, Jiang Y, Liu R, et al. Curcumin Derivative C66 Suppresses Pancreatic Cancer Progression through the Inhibition of JNK-Mediated Inflammation. Molecules. 2022;27(10):3076. Published 2022 May 11. doi:10.3390/molecules27103076(IF:4.412)
[21] Su W, Qiu J, Mei Y, Zhang XE, He Y, Li F. A microfluidic cell chip for virus isolation via rapid screening for permissive cells [published online ahead of print, 2022 May 2]. Virol Sin. 2022;S1995-820X(22)00075-X. doi:10.1016/j.virs.2022.04.011(IF:4.327)
[22] Ding J, Mei S, Cheng W, Ni Z, Yu C. Curcumin treats endometriosis in mice by the HIF signaling pathway. Am J Transl Res. 2022;14(4):2184-2198. Published 2022 Apr 15. (IF:4.060)
[23] Zhang XY, Shen HH, Qin XY, et al. IL-27 promotes decidualization via the STAT3-ESR/PGR regulatory axis. J Reprod Immunol. 2022;151:103623. doi:10.1016/j.jri.2022.103623(IF:4.054)
[24] Zhu Q, Muyayalo KP, Xu QH, Wang J, Wang H, Liao AH. Prunella vulgaris can improve the pregnancy outcomes of experimental autoimmune thyroiditis rats by inhibiting Th1/Th17 immune responses. J Reprod Immunol. 2022;149:103469. doi:10.1016/j.jri.2021.103469(IF:4.054)
[25] Yang Q, Guo K, Zhou X, et al. Histopathology, antioxidant responses, transcriptome and gene expression analysis in triangle sail mussel Hyriopsis cumingii after bacterial infection. Dev Comp Immunol. 2021;124:104175. doi:10.1016/j.dci.2021.104175(IF:3.636)
[26] Liu Y, Wan HH, Tian DM, et al. Development and Characterization of High Efficacy Cell-Penetrating Peptide via Modulation of the Histidine and Arginine Ratio for Gene Therapy. Materials (Basel). 2021;14(16):4674. Published 2021 Aug 19. doi:10.3390/ma14164674(IF:3.623)
[27] Fu Y, Wang X, Zhang L, Ren Y, Hao L. Allograft inflammatory factor-1 enhances inflammation and oxidative stress via the NF-κB pathway in diabetic kidney disease. Biochem Biophys Res Commun. 2022;614:63-69. doi:10.1016/j.bbrc.2022.04.089(IF:3.575)
[28] Zhao Y, Wang XQ. VvMYB1 potentially affects VvTOR gene expression by regulating VvTOR promoter and participates in glucose accumulation. J Plant Physiol. 2022;272:153668. doi:10.1016/j.jplph.2022.153668(IF:3.549)
[29] Cheng Y, Zheng L, Yang C, Zhang W, Wang H. Propofol inhibits proliferation and migration of glioma cells by up-regulating lncRNA GAS5. Toxicol In Vitro. 2022;80:105321. doi:10.1016/j.tiv.2022.105321(IF:3.500)
[30] Yang B, Wang F, Zheng G. Transmembrane protein TMEM119 facilitates the stemness of breast cancer cells by activating Wnt/β-catenin pathway. Bioengineered. 2021;12(1):4856-4867. doi:10.1080/21655979.2021.1960464(IF:3.269)
[31] Yang X, Liu X, Song F, et al. Seasonal expressions of GPR41 and GPR43 in the colon of the wild ground squirrels (Spermophilus dauricus). Eur J Histochem. 2022;66(1):3351. Published 2022 Jan 21. doi:10.4081/ejh.2022.3351(IF:3.188)
[32] Tang Z, Yuan X, Bai Y, et al. Seasonal changes in the expression of PACAP, VPAC1, VPAC2, PAC1 and testicular activity in the testis of the muskrat (Ondatra zibethicus). Eur J Histochem. 2022;66(2):3398. Published 2022 May 2. doi:10.4081/ejh.2022.3398(IF:3.188)
[33] Zhu P, Chen Y, Wu F, Meng M, Ji K. Expression and promoter analysis of MEP pathway enzyme-encoding genes in Pinus massoniana Lamb. PeerJ. 2022;10:e13266. Published 2022 Apr 12. doi:10.7717/peerj.13266(IF:2.984)
[34] Zhai L, Chen W, Cui B, Yu B, Wang Y, Liu H. Overexpressed versican promoted cell multiplication, migration and invasion in gastric cancer. Tissue Cell. 2021;73:101611. doi:10.1016/j.tice.2021.101611(IF:2.466)
[35] Jiang J, Cai M. Cardamonin Inhibited IL-1β Induced Injury by Inhibition of NLRP3 Inflammasome via Activating Nrf2/NQO-1 Signaling Pathway in Chondrocyte. J Microbiol Biotechnol. 2021;31(6):794-802. doi:10.4014/jmb.2103.03057(IF:2.351)





