RCA (E1A) Copynumber Detection Kit RCA (E1A) 基因拷贝数检测试剂盒
产品介绍
RCA(E1A)基因拷贝数检测试剂盒可用于定量分析检测各种使用腺病毒载体相关的细胞治疗产品和基因治疗产品中可能发生的复制型腺病毒(Replication-competentAdenoviruses,RCA)的潜在风险;还可用于定量分析检测生物制品中宿主细胞,如HEK293和HEK293T细胞来源的风险基因E1A残留DNA的含量。本试剂盒针对腺病毒上E1A基因序列设计特异性引物,采用探针法荧光定量PCR原理,快速特异的检测复制型腺病毒RCA风险情况以及宿主细胞来源的E1A残留DNA,其定量限可低至4.1copies/μL水平,且配套有RCA(E1A)DNAControl(DNA定量参考品)。该试剂可与本公司的磁珠法残留DNA样本前处理试剂(Cat#18461ES/18462ES)配套使用。
产品特色
- 抗干扰性:针对复杂基质,样本加标回收率至少能达到70%~130%;
- 灵敏度高:定量下限(LLOQ)为4.1 copies/μL;
- 精密度高:批内重复性高CV<10%,批间差异小即中间精密度CV<15%;
- 专属性强:特异性检测目的基因序列,不受其他外源基因组DNA干扰;
- 防干扰强:引入内部质控(IC),可排除样本干扰、反应配制异常等,避免假阴性。
- 验证完善:参考ICH Q2(R2)分析方法验证指导原则,可提供完善的验证报告;
- 符合法规:按照EP2.6.7、JP G3和USP 63药典要求验证,符合国际权威机构的标准;
- 保障品质:试剂盒所需酶原料全自产,且已产业化,供货稳定。
应用案例
1. 检测范围
试剂盒线性范围在1.64×101~1.64×105copies/μL,R2=1,扩增效率为100.248%,各浓度检测值CV<15%。
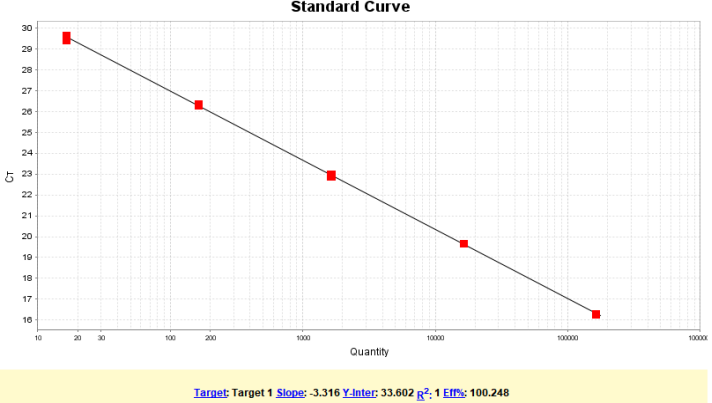
图1. RCA (E1A) DNA标曲线性图
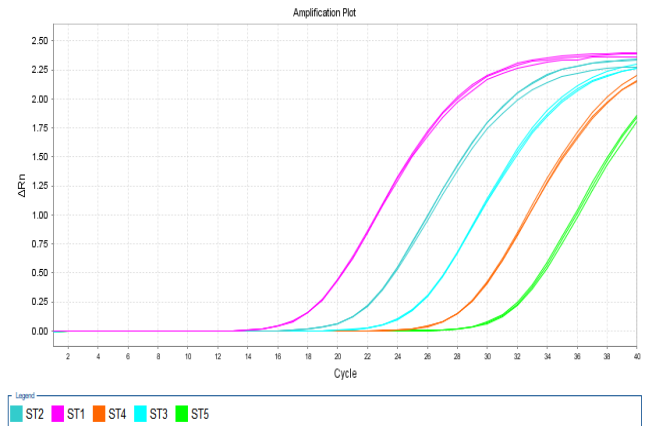
图2. 扩增曲线线性图谱
存储条件
1. 所有组分均干冰运输,-25~-15℃保存,有效期2年。其中,41321-A和41321-B均需避光保存。
2. 收到货后,请检查共5个组分是否齐全,并立即放入对应的保存温度中储存。
COA
相关产品
联系我们





