Replication-competent Retrovirus (RCR) Detection Kit 复制型逆转录病毒(RCR)检测试剂盒
产品介绍
复制型逆转录病毒(RCR)检测试剂盒是用于定量分析检测各种使用逆转录病毒载体生产的细胞治疗产品和基因治疗产品中可能发生的复制型逆转录病毒的潜在风险。本试剂盒针对逆转录病毒载体上特定序列设计特异性引物,采用qPCR荧光探针原理,专一快速的检测复制型逆转录病毒RCR风险情况,其最低定量限可以达到10 copies/μL水平,最低检测限可以达到0.3 copies/μL水平,且配套有RCR DNA Control(DNA定量参考品)。该试剂盒需要与本公司的磁珠法残留DNA样本前处理试剂盒(Cat#18461ES)配套使用。
产品特色
- 抗干扰性:针对复杂基质,样本加标回收率至少能达到70%~130%;
- 灵敏度高:定量下限(LLOQ)为10 copies/μL,检测下限(LLOD)为0.3 copies/μL;
- 精密度高:批内重复性高CV<10%,批间差异小即中间精密度CV<15%;
- 专属性强:特异性检测目的基因序列,不受其他外源基因组DNA干扰;
- 防干扰强:引入内部质控(IC),可排除样本干扰、反应配制异常等,避免假阴性。
- 验证完善:参考ICH Q2(R2)分析方法验证指导原则,可提供完善的验证报告。
应用案例
1.检测范围
试剂盒线性范围为:5×106 copies/μL~5×101 copies/μL,R2=1,90%≤扩增效率≤110%,各浓度检测值CV<15%。 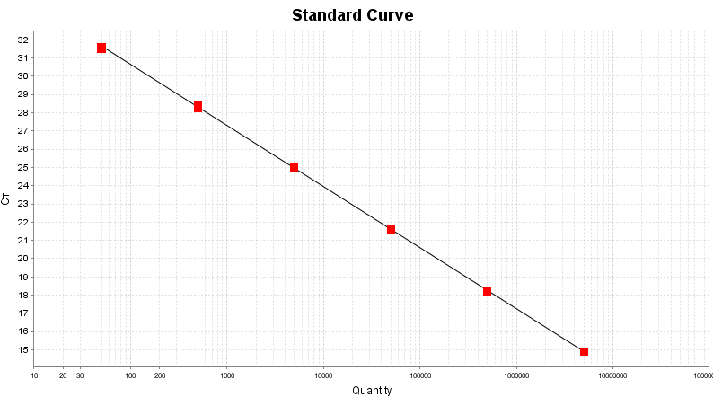
图1. RCR DNA标曲线性图
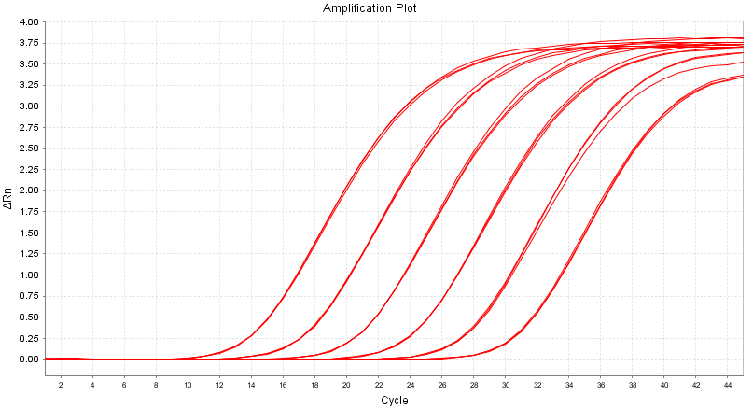
图2. 扩增曲线线性图
存储条件
1. 所有组分均干冰运输,-25~-15℃保存,有效期2年。其中,41329-A需避光保存。
2. 收到货后,请检查共5个组分是否齐全,并立即放入对应的保存温度中储存。
COA
相关产品
联系我们





