Replication-competent Lentivirus (RCL) Detection Kit 复制型慢病毒(RCL)检测试剂盒
产品介绍
复制型慢病毒(RCL)检测试剂盒是用于定量分析检测各种使用慢病毒载体相关的细胞产品中可能发生的复制型慢病毒的潜在风险。本试剂盒针对慢病毒的包膜蛋白VSV-G基因序列设计特异性引物,采用qPCR荧光探针原理,专一快速的检测复制型慢病毒RCL风险情况,其最低检测限可以达到1.05 copies/μL水平,且配套有RCL DNA Control(DNA定量参考品)。该试剂盒需要与本公司的磁珠法残留DNA样本前处理试剂盒(Cat#18461ES/18462ES)配套使用。
产品特色
- 符合法规:按照法规要求进行全面验证,可提供验证报告;
- 保障品质:试剂盒原材料全自主研发,qPCR Mix等酶产品在超洁净酶工厂生产;
- 灵敏度高:定量限可达2.1 copies/μL水平;
- 精密度高:批内重复性高,批间差异小;
- 专属性强:特异性检测VSV-G基因,不受其他外源基因组DNA干扰;
- 防干扰强:添加内部对照(IC),便于排除样本干扰、反应配制异常等因素
应用案例
1.检测范围
试剂盒线性范围为:5×101 - 5×106 copies/μL,R2=1,扩增效率为99.095%,各浓度检测值CV<15%。
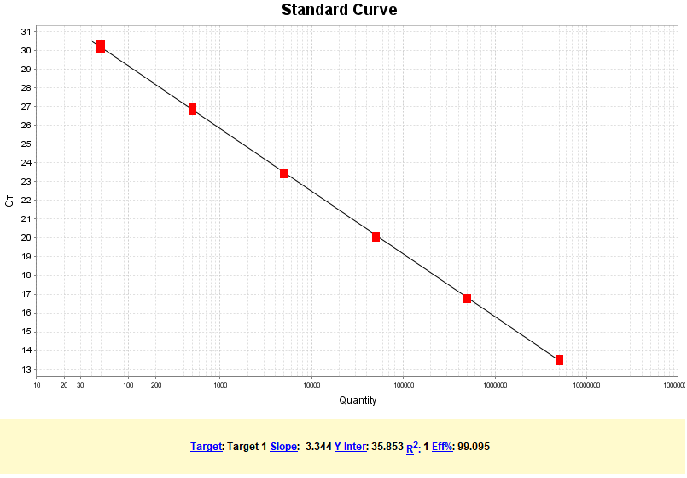
图1. RCL DNA 标曲线性图
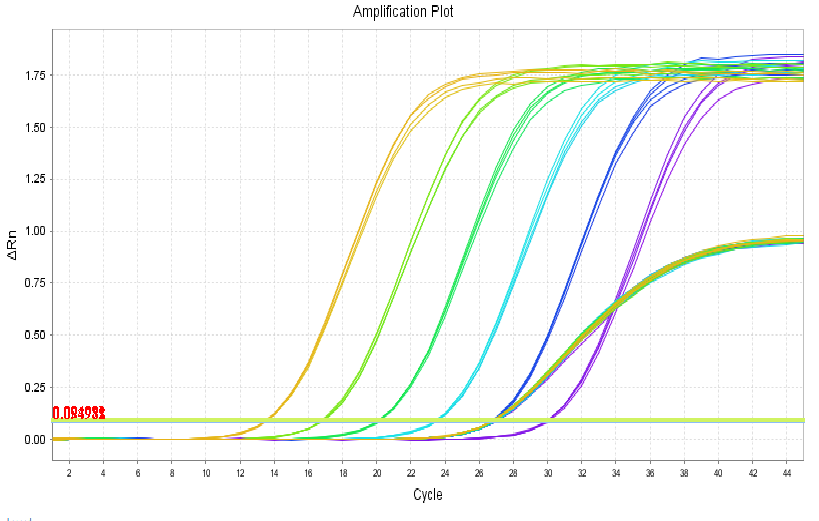
图2. 扩增曲线线性图
存储条件
1. 所有组分均干冰运输,-25~-15℃保存,有效期2年。且41311-A和41311-B均需避光保存。
2. 收到货后,请检查共5个组分是否齐全,并立即放入对应的保存温度中储存。
COA
相关产品
联系我们





