Hieff NGS® Fast Tagment DNA Library Prep Kit for Illumina® (for 50 ng)是针对 lllumina®高通量测序平台专业开发设计的转座酶法建库试剂盒,适用于50 ng的基因组DNA、cDNA、扩增子(>500 bp)等样本的建库。与常规分步法建库相比,Hieff NGS® Fast Tagment DNA Library Prep Kit for Illumina®采用新型转座酶和优化的缓冲体系,仅需10 min即可完成DNA片段化、末端修复和接头连接过程,显著缩短建库时间至1.5小时以内,并获得优异的测序质量。此外,本试剂盒已经不同GC含量DNA样本的验证,无偏好性或仅具有极低的偏好性。本试剂盒提供的所有试剂盒组分,都经过严格的质量与功能验证,最高程度保障产品优异性能与批间稳定性。
- 单管酶促反应,仅需10 min即可完成DNA片段化、末端修复和接头连接过程。
- 文库扩增专用聚合酶,较大程度上保证了文库扩增的均一性。
- 单个样品建库时间少于90分钟。
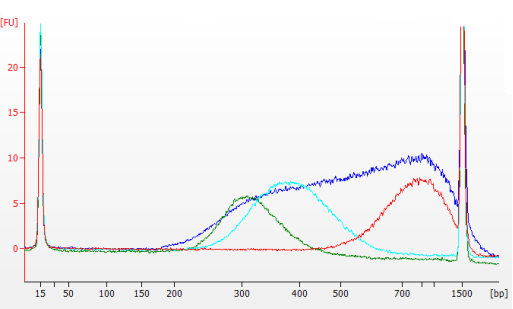
使用Hieff NGS® Fast Tagment DNA Library Prep Kit for Illumina®对50 ng嗜盐杆菌gDNA样本建库,并分别使用1.0×磁珠进行纯化,0.8×/0.2×、0.7×/0.2×、0.5×/0.15×磁珠比例进行长度分选,结果使用Agilent 2100 Bioanalyzer进行检测。
-25~-15℃保存。
[1] Ouyang J, Cai Z, Guo Y, Nie F, Cao M, Duan X. Detection of a novel PAX6 variant in a Chinese family with multiple ocular abnormalities. BMC Ophthalmol. 2022;22(1):28. Published 2022 Jan 16. doi:10.1186/s12886-022-02256-7(IF:2.086)





