Hieff NGS® DNA Library Prep Kit/兼容Illumina和MGI双平台机械法DNA建库试剂盒
产品介绍
Hieff NGS® DNA Library Prep Kit 是针对 Illumina®和 MGI®高通量测序平台专业开发设计的新一代建库试剂盒。本产品采用高质量的酶学组成,在前一代建库试剂盒的基础上,改进了DNA片段末端修复和加A效率,同时改善了接头连接效率。本试剂盒采用新型的高保真酶,显著提高扩增均一性和保真性,可应用于常规动植物基因组、微生物基因组、FFPE、cfDNA、ChIP DNA等样本,助力获得优异的测序数据。
产品特色
- 适用100 pg-1000 ng所有DNA样本,包含cfDNA、FFPE等 。
- 业界领先的文库转化率,最高可达70%以上 。
- 多样本验证可获得优异的文库与测序数据 。
- 严格的批次性能与稳定性质控 。
应用案例
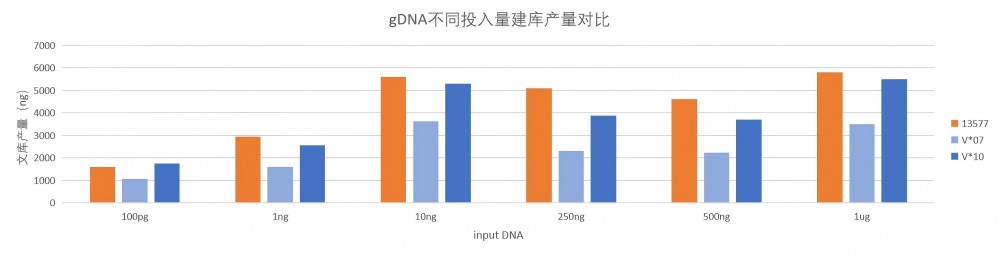
两种竞品试剂盒相比,13577对常规gDNA样本建库的产量略偏高。
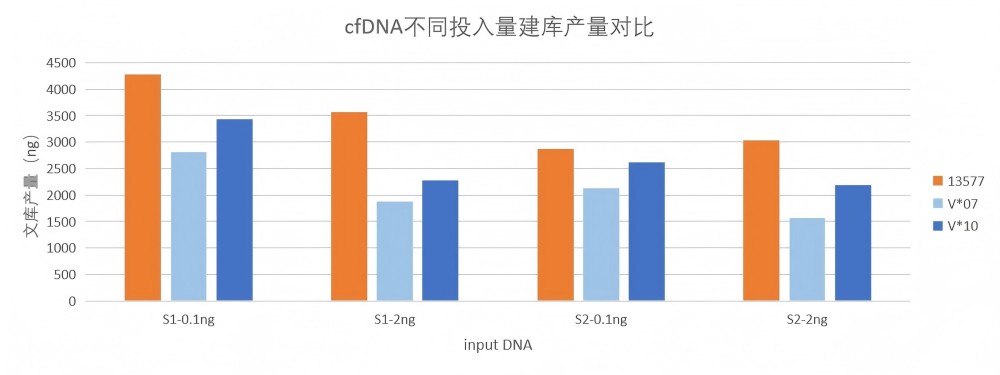
两种竞品试剂盒相比,13577对cfDNA真实样本建库的产量明显偏高。
两种竞品试剂盒相比,13577对FFPE样本建库的产量偏高;尤其针对低质量、低投入量FFPE样本,13577产量有较为明显优势。

存储条件
-25~-15 °C保存。
COA





