Hieff Clone® Plus One Step Cloning Kit是一款简便、快速、高效的DNA定向克隆产品,该试剂盒可以将PCR产物定向克隆至任何载体的任何位点,可高效克隆50 bp-10 kb片段。将载体线性化,并在插入片段正、反向PCR引物5’端引入15-25 bp的线性化载体末端同源序列,使得插入片段PCR产物5’和3’末端分别带有与线性化载体两末端对应的完全一致的序列。PCR产物和线性化载体在重组酶的作用下,仅需50℃反应20 min即可进行转化,完成定向克隆。克隆阳性率可达95%以上。
- 阳性率高
- 单片段高效重组
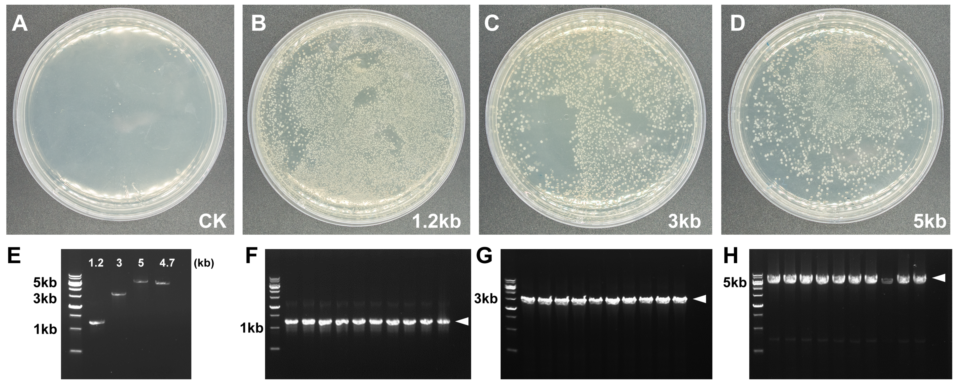
Hieff Clone® One Step Cloning Kit(Cat# 10911)可以有效克隆不同长度的单片段基因。A-D:重组转化平板。E:插入片段和载体浓度检测电泳图。F-H:插入片段PCR鉴定电泳图。箭头指示目的条带。载体:pFastBac1,4.7 kb,插入片段大小分别是1.2 kb,3 kb和5 kb,载体与插入片段摩尔比:1:3,重组反应条件:50℃,20 min。
冰袋运输。-20℃保存,有效期1年。
[1] Xu Y, Yu Q, Wang P, et al. A Selective Small-Molecule c-Myc Degrader Potently Regresses Lethal c-Myc Overexpressing Tumors. Adv Sci (Weinh). 2022;9(8):e2104344. doi:10.1002/advs.202104344(IF:16.806)
[2] Guan B, Jiang YT, Lin DL, Lin WH, Xue HW. Phosphatidic acid suppresses autophagy through competitive inhibition by binding GAPC (glyceraldehyde-3-phosphate dehydrogenase) and PGK (phosphoglycerate kinase) proteins [published online ahead of print, 2022 Mar 15]. Autophagy. 2022;1-15. doi:10.1080/15548627.2022.2046449(IF:16.016)
[3] He X, Li Y, Chen Q, et al. O-GlcNAcylation and stablization of SIRT7 promote pancreatic cancer progression by blocking the SIRT7-REGγ interaction [published online ahead of print, 2022 Apr 14]. Cell Death Differ. 2022;10.1038/s41418-022-00984-3. doi:10.1038/s41418-022-00984-3(IF:15.828)
[4] Li T, Chen X, Qian Y, et al. A synthetic BRET-based optogenetic device for pulsatile transgene expression enabling glucose homeostasis in mice. Nat Commun. 2021;12(1):615. Published 2021 Jan 27. doi:10.1038/s41467-021-20913-1(IF:14.919)
[5] Zhou T, Zhu X, Ye Z, et al. Lupus enhancer risk variant causes dysregulation of IRF8 through cooperative lncRNA and DNA methylation machinery. Nat Commun. 2022;13(1):1855. Published 2022 Apr 6. doi:10.1038/s41467-022-29514-y(IF:14.919)
[6] Wu P, Zhang T, Liu B, et al. Mechano-regulation of Peptide-MHC Class I Conformations Determines TCR Antigen Recognition. Mol Cell. 2019;73(5):1015-1027.e7. doi:10.1016/j.molcel.2018.12.018(IF:14.548)
[7] Xiong L, Liu S, Chen S, et al. A new type of DNA phosphorothioation-based antiviral system in archaea. Nat Commun. 2019;10(1):1688. Published 2019 Apr 11. doi:10.1038/s41467-019-09390-9(IF:11.878)
[8] Yu Z, Shi M, Stewart T, et al. Reduced oligodendrocyte exosome secretion in multiple system atrophy involves SNARE dysfunction. Brain. 2020;143(6):1780-1797. doi:10.1093/brain/awaa110(IF:11.337)
[9] Li S, Yang X, Huang H, et al. Arabidopsis ACYL-ACTIVATING ENZYME 9 (AAE9) encoding an isobutyl-CoA synthetase is a key factor connecting branched-chain amino acid catabolism with iso-branched wax biosynthesis. New Phytol. 2022;233(6):2458-2470. doi:10.1111/nph.17941(IF:10.152)
[10] Jiang L, Wang Y, Xia A, et al. A natural single-nucleotide polymorphism variant in sulfite reductase influences sulfur assimilation in maize. New Phytol. 2021;232(2):692-704. doi:10.1111/nph.17616(IF:10.152)
[11] Chen S, Wu H, Wang Z, et al. Loss of SPTBN1 Suppresses Autophagy Via SETD7-mediated YAP Methylation in Hepatocellular Carcinoma Initiation and Development. Cell Mol Gastroenterol Hepatol. 2022;13(3):949-973.e7. doi:10.1016/j.jcmgh.2021.10.012(IF:9.225)
[12] Sun J, Wang X, Xu RG, et al. HP1c regulates development and gut homeostasis by suppressing Notch signaling through Su(H). EMBO Rep. 2021;22(4):e51298. doi:10.15252/embr.202051298(IF:8.807)
[13] Zhao J, Long T, Wang Y, et al. RMS2 Encoding a GDSL Lipase Mediates Lipid Homeostasis in Anthers to Determine Rice Male Fertility. Plant Physiol. 2020;182(4):2047-2064. doi:10.1104/pp.19.01487(IF:6.902)
[14] Yang X, Feng T, Li S, et al. CER16 Inhibits Post-Transcriptional Gene Silencing of CER3 to Regulate Alkane Biosynthesis. Plant Physiol. 2020;182(3):1211-1221. doi:10.1104/pp.19.01002(IF:6.902)
[15] Liu L, Jiang S, Xing M, et al. Structural Analysis of an l-Cysteine Desulfurase from an Ssp DNA Phosphorothioation System. mBio. 2020;11(2):e00488-20. Published 2020 Apr 28. doi:10.1128/mBio.00488-20(IF:6.784)
[16] Dong W, Dai ZH, Liu FC, et al. The RNA-binding protein RBM3 promotes cell proliferation in hepatocellular carcinoma by regulating circular RNA SCD-circRNA 2 production. EBioMedicine. 2019;45:155-167. doi:10.1016/j.ebiom.2019.06.030(IF:6.680)
[17] Xiao Y, Ma W, Hu W, et al. Ubiquitin-specific peptidase 39 promotes human glioma cells migration and invasion by facilitating ADAM9 mRNA maturation. Mol Oncol. 2022;16(2):388-404. doi:10.1002/1878-0261.12958(IF:6.603)
[18] Shen Z, Li W, Li Y, et al. The red flower wintersweet genome provides insights into the evolution of magnoliids and the molecular mechanism for tepal color development. Plant J. 2021;108(6):1662-1678. doi:10.1111/tpj.15533(IF:6.486)
[19] Xia C, Gong Y, Chong K, Xu Y. Phosphatase OsPP2C27 directly dephosphorylates OsMAPK3 and OsbHLH002 to negatively regulate cold tolerance in rice. Plant Cell Environ. 2021;44(2):491-505. doi:10.1111/pce.13938(IF:6.362)
[20] Cao G, Li P, He X, et al. FHL3 Contributes to EMT and Chemotherapy Resistance Through Up-Regulation of Slug and Activation of TGFβ/Smad-Independent Pathways in Gastric Cancer. Front Oncol. 2021;11:649029. Published 2021 Jun 4. doi:10.3389/fonc.2021.649029(IF:6.244)
[21] Li X, Chen T, Wu X, et al. Apoptosis-Inducing Factor 2 (AIF-2) Mediates a Caspase-Independent Apoptotic Pathway in the Tropical Sea Cucumber (Holothuria leucospilota). Int J Mol Sci. 2022;23(6):3008. Published 2022 Mar 10. doi:10.3390/ijms23063008(IF:5.924)
[22] Lu J, Sun J, Jiang A, et al. Alternate expression of CONSTANS-LIKE 4 in short days and CONSTANS in long days facilitates day-neutral response in Rosa chinensis. J Exp Bot. 2020;71(14):4057-4068. doi:10.1093/jxb/eraa161(IF:5.908)
[23] Peng Z, Wang M, Zhang L, et al. EjRAV1/2 Delay Flowering Through Transcriptional Repression of EjFTs and EjSOC1s in Loquat. Front Plant Sci. 2021;12:816086. Published 2021 Dec 31. doi:10.3389/fpls.2021.816086(IF:5.754)
[24] Tang W, Zhao Y, Zeng J, et al. Integration of Small RNA and Transcriptome Sequencing Reveal the Roles of miR395 and ATP Sulfurylase in Developing Seeds of Chinese Kale. Front Plant Sci. 2022;12:778848. Published 2022 Feb 3. doi:10.3389/fpls.2021.778848(IF:5.754)
[25] Tan H, Yang X, Dai Q, Deng Z, Qu X. Unravelling the Biosynthetic Flexibility of UK-2A Enables Enzymatic Synthesis of Its Structural Variants. ACS Synth Biol. 2019;8(12):2659-2665. doi:10.1021/acssynbio.9b00387(IF:5.571)
[26] Yan Q, Han L, Liu X, You C, Zhou S, Zhou Z. Development of an auto-inducible expression system by nitrogen sources switching based on the nitrogen catabolite repression regulation. Microb Cell Fact. 2022;21(1):73. Published 2022 Apr 28. doi:10.1186/s12934-022-01794-5(IF:5.328)
[27] Cai M, Liu J, Song X, et al. De novo biosynthesis of p-coumaric acid and caffeic acid from carboxymethyl-cellulose by microbial co-culture strategy. Microb Cell Fact. 2022;21(1):81. Published 2022 May 10. doi:10.1186/s12934-022-01805-5(IF:5.328)
[28] Shi Y, Chen K, Long L, Ding S. A highly xyloglucan active lytic polysaccharide monooxygenase EpLPMO9A from Eupenicillium parvum 4-14 shows boosting effect on hydrolysis of complex lignocellulosic substrates. Int J Biol Macromol. 2021;167:202-213. doi:10.1016/j.ijbiomac.2020.11.177(IF:5.162)
[29] Peng F, Ou XY, Guo ZW, Zeng YJ, Zong MH, Lou WY. Co-immobilization of multiple enzymes by self-assembly and chemical crosslinking for cofactor regeneration and robust biocatalysis. Int J Biol Macromol. 2020;162:445-453. doi:10.1016/j.ijbiomac.2020.06.141(IF:5.162)
[30] Wang M, Nie Y, Wu XL. Membrane vesicles from a Dietzia bacterium containing multiple cargoes and their roles in iron delivery. Environ Microbiol. 2021;23(2):1009-1019. doi:10.1111/1462-2920.15278(IF:4.933)
[31] Li P, Cao G, Zhang Y, et al. FHL3 promotes pancreatic cancer invasion and metastasis through preventing the ubiquitination degradation of EMT associated transcription factors. Aging (Albany NY). 2020;12(1):53-69. doi:10.18632/aging.102564(IF:4.831)
[32] Li C, Liu XJ, Yan Y, et al. OsLHY is involved in regulating flowering through the Hd1- and Ehd1- mediated pathways in rice (Oryza sativa L.). Plant Sci. 2022;315:111145. doi:10.1016/j.plantsci.2021.111145(IF:4.729)
[33] Chen B, Chen Z, Wang Y, et al. ORF4 of the Temperate Archaeal Virus SNJ1 Governs the Lysis-Lysogeny Switch and Superinfection Immunity. J Virol. 2020;94(16):e00841-20. Published 2020 Jul 30. doi:10.1128/JVI.00841-20(IF:4.501)
[34] Wang X, Wang G, Qu J, Yuan Z, Pan R, Li K. Calcipotriol Inhibits NLRP3 Signal Through YAP1 Activation to Alleviate Cholestatic Liver Injury and Fibrosis. Front Pharmacol. 2020;11:200. Published 2020 Mar 31. doi:10.3389/fphar.2020.00200(IF:4.225)
[35] Fei J, Wang YS, Cheng H, Su YB, Zhong Y, Zheng L. Cloning and characterization of KoOsmotin from mangrove plant Kandelia obovata under cold stress. BMC Plant Biol. 2021;21(1):10. Published 2021 Jan 6. doi:10.1186/s12870-020-02746-0(IF:4.215)
[36] Zhao Z, Qin X. MicroRNA-708 targeting ZNF549 regulates colon adenocarcinoma development through PI3K/AKt pathway. Sci Rep. 2020;10(1):16729. Published 2020 Oct 7. doi:10.1038/s41598-020-73929-w(IF:3.998)
[37] Sun J, Yuan X, Li Y, Wang X, Chen J. The pathway of 2,2-dichlorovinyl dimethyl phosphate (DDVP) degradation by Trichoderma atroviride strain T23 and characterization of a paraoxonase-like enzyme. Appl Microbiol Biotechnol. 2019;103(21-22):8947-8962. doi:10.1007/s00253-019-10136-2(IF:3.670)
[38] Zhang L, Jiang Y, Zhu Y, et al. Functional characterization of GI and CO homologs from Eriobotrya deflexa Nakai forma koshunensis. Plant Cell Rep. 2019;38(5):533-543. doi:10.1007/s00299-019-02384-3(IF:3.499)
[39] Peng Q, Cai Y, Lai E, et al. The sucrose transporter MdSUT4.1 participates in the regulation of fruit sugar accumulation in apple. BMC Plant Biol. 2020;20(1):191. Published 2020 May 6. doi:10.1186/s12870-020-02406-3(IF:3.497)
[40] Chen HY, Gao LT, Yuan JQ, et al. Decrease in SHP-1 enhances myometrium remodeling via FAK activation leading to labor. Am J Physiol Endocrinol Metab. 2020;318(6):E930-E942. doi:10.1152/ajpendo.00068.2020(IF:3.469)
[41] Li T, Hu X, Zhang T, et al. Cloning, analysis, and anti-duck Tembusu virus innate immune response of Cherry Valley duck tripartite motif-containing 32. Poult Sci. 2021;100(5):101048. doi:10.1016/j.psj.2021.101048(IF:3.352)
[42] Li T, Zhai X, Wang W, et al. Regulation of MDA5-dependent anti-Tembusu virus innate immune responses by LGP2 in ducks. Vet Microbiol. 2021;263:109281. doi:10.1016/j.vetmic.2021.109281(IF:3.293)
[43] Sun N, Chen H, Ma Y, et al. H3K4me3-Mediated Upregulation of LncRNA-HEIPP in Preeclampsia Placenta Affects Invasion of Trophoblast Cells. Front Genet. 2020;11:559478. Published 2020 Dec 11. doi:10.3389/fgene.2020.559478(IF:3.260)
[44] Yang X, Wang Z, Feng T, et al. Evolutionarily conserved function of the sacred lotus (Nelumbo nucifera Gaertn.) CER2-LIKE family in very-long-chain fatty acid elongation. Planta. 2018;248(3):715-727. doi:10.1007/s00425-018-2934-6(IF:3.249)
[45] Ma L, Fan Z, Du G, Wang H. Leptin-elicited miRNA-342-3p potentiates gemcitabine resistance in pancreatic ductal adenocarcinoma. Biochem Biophys Res Commun. 2019;509(3):845-853. doi:10.1016/j.bbrc.2019.01.030(IF:2.705)
[46] Li S, Huang JC. Assessment of Expression Cassettes and Culture Media for Different Escherichia coli Strains to Produce Astaxanthin. Nat Prod Bioprospect. 2018;8(5):397-403. doi:10.1007/s13659-018-0172-z(IF:0.000)





