Hieff Clone® Universal II One Step Cloning Kit现已升级,克隆阳性率大大提升!
Hieff Clone® Universal II One Step Cloning Kit是新一代的同源重组克隆试剂盒,精心优化的第二代2× Hieff Clone® Universal II Enzyme Premix预混了重组酶和重组反应所需缓冲液,并添加了独特的重组增强因子,可显著提高重组克隆效率。
该试剂盒可以将PCR产物定向克隆至任何载体的任何位点,兼容未纯化PCR产物、直接回收的PCR产物、低浓度的胶回收产物,本产品可重组同源臂GC含量30%-70%的接头片段。将载体完全线性化,并在插入片段正、反向PCR引物5’端引入15-25 bp的线性化载体末端同源序列,使得插入片段PCR产物5’和3’末端分别带有与线性化载体两末端对应的完全一致的序列。PCR产物和线性化载体在重组酶的作用下,在50℃条件下最快仅需5 min即可完成重组反应。克隆阳性率可达95%以上。
- 定向:可满足1-7个DNA片段的定向无缝拼接;
- 简便:片段无需酶切,多片段连接一管内即可完成;
- 快速:最快5分钟即可完成连接反应;
- 高效:克隆生长数多,克隆阳性率可达95%以上;
- 广泛:适用于任何载体,兼顾粘性和平末端;可用于多片段、点突变等的克隆;
- 超长:载体片段连接长度可达25 kb以上。
- 单片段6 μL小体系高效重组
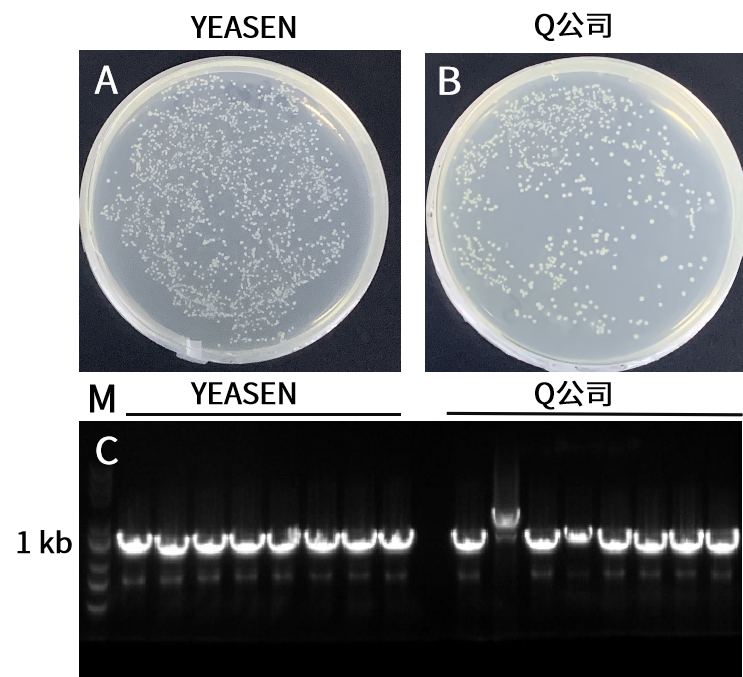
图1. 在6 μL小体系非复苏感受态下,连接10 ng低投入量单片段。结果显示,10923ES性能好于竞品,连接效率高,菌落数多,阳性率达100%。A-B:重组转化平板。载体(10 kb)和插入片段(1 kb)摩尔比为1:2。C:插入片段PCR鉴定电泳图,M:Yeasen 10505ES。
- 多片段高效重组

两片段(3 kb)连接。结果显示,10923ES菌落数多,阳性率100%。A:重组转化平板。载体(11.6 kb)和插入片段(3 kb)摩尔比为1:2。B:插入片段PCR鉴定电泳图,M:Yeasen 10505ES。
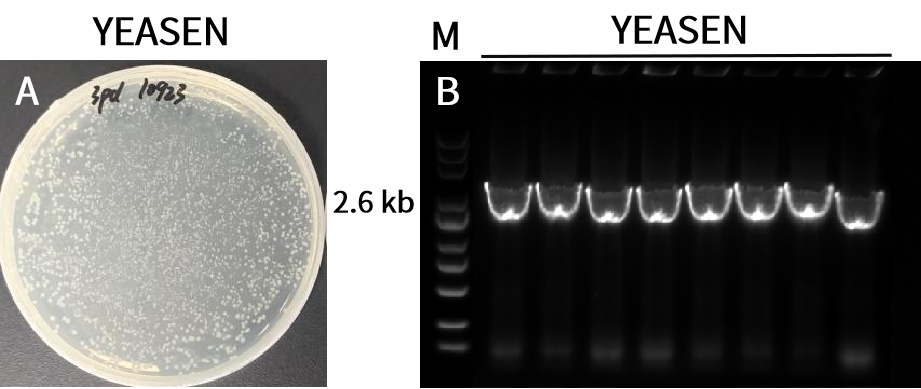
三片段(4.4 kb)连接。结果显示,10923ES菌落数多,阳性率100%。A:重组转化平板。载体(11.6 kb)和插入片段(4.4 kb)摩尔比为1:2。B:插入片段PCR鉴定电泳图,M:Yeasen 10505ES,菌落PCR长度2.6 kb。
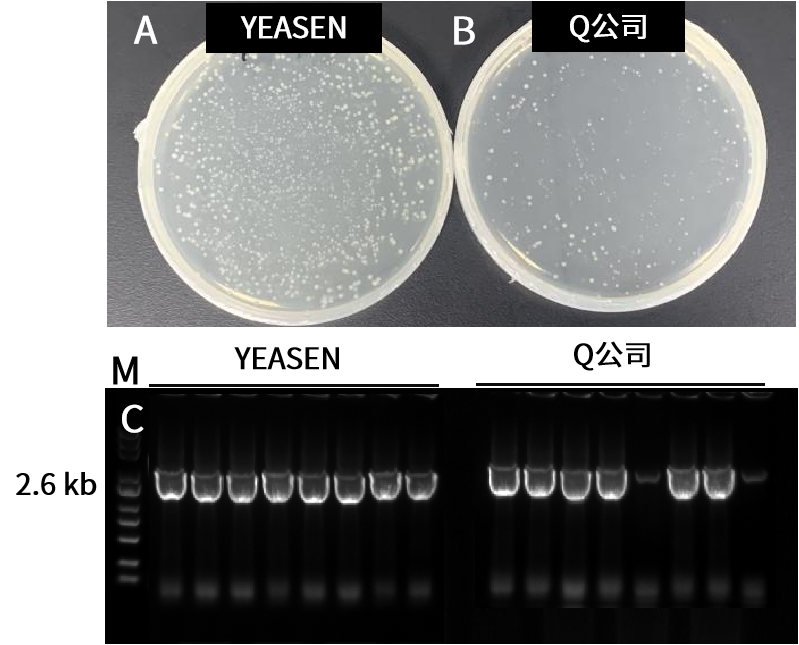
六片段(7.6 kb)连接。结果显示,10923ES产品性能好于竞品,菌落数多,阳性率100%。A-B:重组转化平板。载体(11.6 kb)和插入片段(7.6 kb)摩尔比为1:2。C:插入片段PCR鉴定电泳图,M:Yeasen 10505ES,菌P长度2.6 kb。
- 25 kb以上超长片段轻松高效重组

超长片段连接。结果显示,10923ES菌落数多,阳性率100%。A:重组转化平板。载体(21 kb)和插入片段(4.5 kb)摩尔比为1:2。B:插入片段PCR鉴定电泳图,M:Yeasen 10505ES。
- 低浓度多片段高效重组
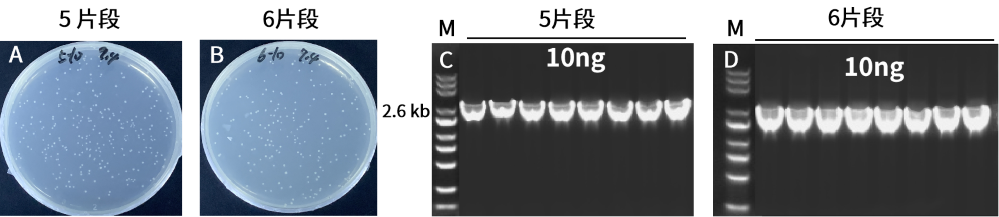
分别连接低浓度的五片段和六片段。结果显示,10923ES在低浓度下连接性能稳定,菌落数多,阳性率100%。A-B:重组转化平板。载体(11.6 kb)和插入片段(5片段共5.6 kb、六片段共7.6 kb)摩尔比为1:2。C-D:插入片段PCR鉴定电泳图,M:Yeasen 10505ES,菌P长度2.6 kb。
- 试剂盒稳定性好
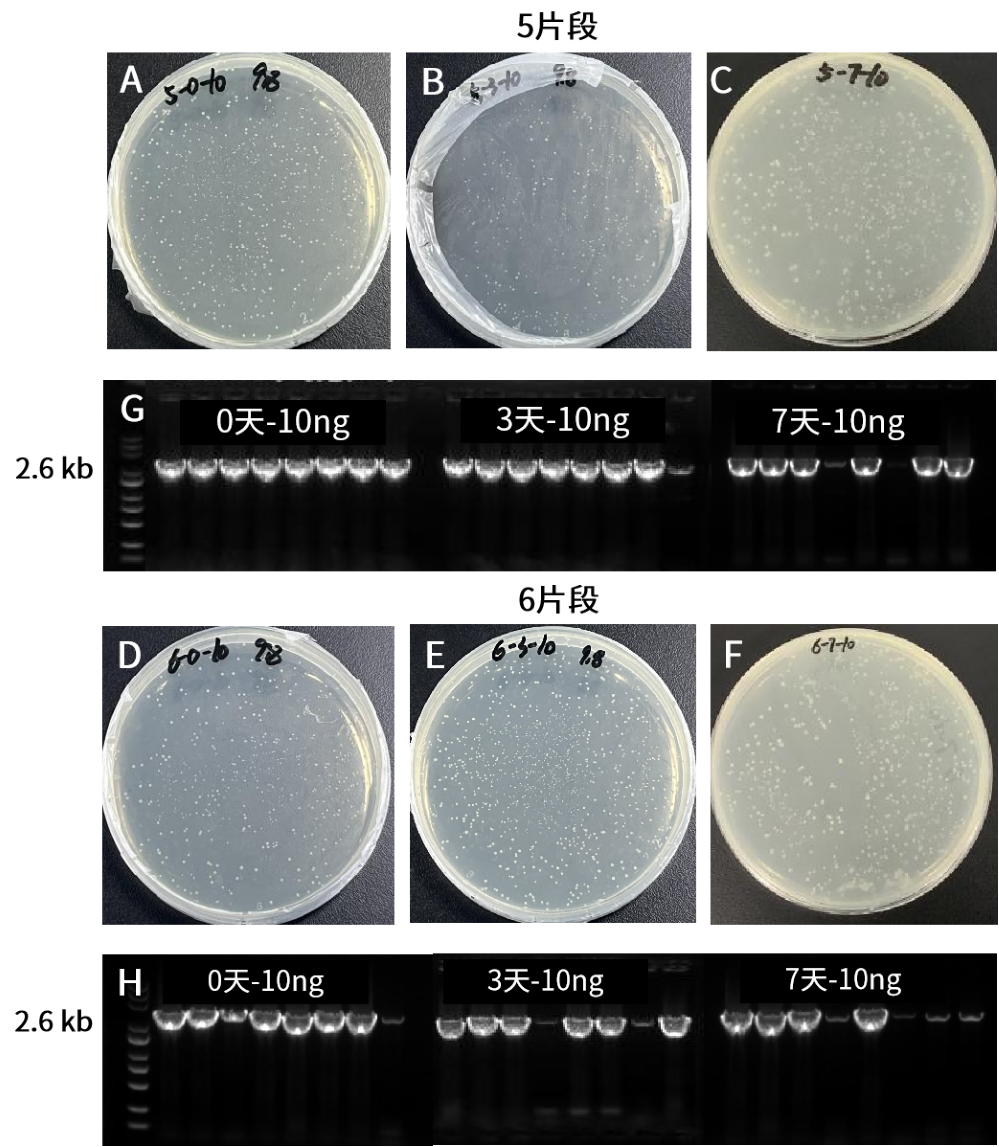
在37℃条件下放置7天,结果显示,10923ES在低浓度下依旧稳定连接五片段和六片段。A-F:重组转化平板。载体(11.6 kb)和插入片段(5片段共5.6 kb、六片段共7.6 kb)摩尔比为1:2。G-H:插入片段PCR鉴定电泳图,M:Yeasen 10505ES,菌P长度2.6 kb。
组分A、B、C:-25~-15℃保存,有效期1年。
组分D:室温保存,有效期2年。







