Hieff Clone® Universal One Step Cloning Kit是新一代的同源重组克隆试剂盒,精心优化的2×Hieff Clone® Universal Enzyme Premix预混了重组酶和重组反应所需缓冲液,并添加了独特的重组增强因子,可显著提高重组克隆效率。
该试剂盒可以将PCR产物定向克隆至任何载体的任何位点,浓度可低至5 ng/μL,一次可实现多至6个片段的顺序拼接克隆。将载体线性化,并在插入片段正、反向PCR引物5’端引入15-25 bp的线性化载体末端同源序列,使得插入片段PCR产物5’和3’末端分别带有与线性化载体两末端对应的完全一致的序列。PCR产物和线性化载体在重组酶的作用下,仅需50℃,5-15 min即可完成重组反应。克隆阳性率可达95%以上。
- 定向:可满足1-6个DNA片段定向插入
- 简便:多片段连接一管内即可完成
- 快速:最快5分钟即可完成连接反应
- 高效:克隆生长数多,克隆阳性率可达95%以上
- 克隆生长数多,单片段克隆阳性率在95%以上

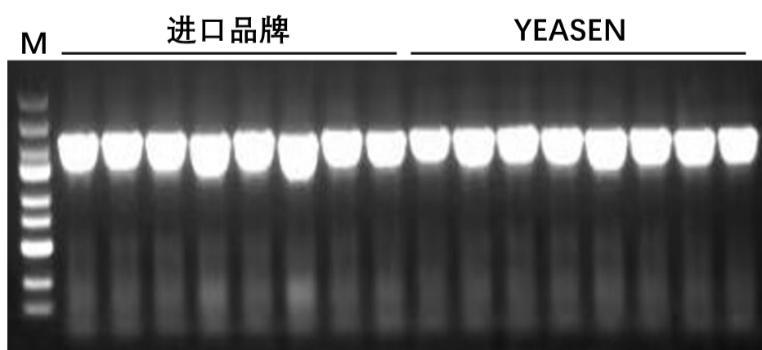
图1. Hieff Clone® Universal One Step Cloning Kit可以有效克隆单片段基因。A-B:重组转化平板。载体(pGEX4T-1,5 kb)和插入片段(2000 bp)摩尔比为1:3。C:插入片段PCR鉴定电泳图,M:5000 DNA Marker。载体量:5 ng/20 μL反应体系,反应条件:50℃,5 min。结果显示YEASEN产品性能媲美进口品牌。
- 2-6个多片段轻松克隆
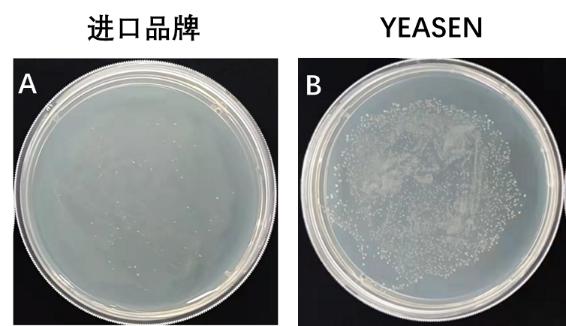
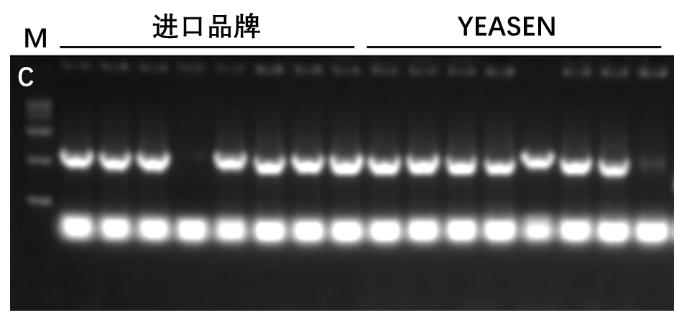
图2. Hieff Clone® Universal One Step Cloning Kit 进行两片段克隆。A-B:重组转化平板。载体(pLacZi,6.9 kb)和插入片段(0.5 kb和1 kb)摩尔比为1:3。C:插入片段PCR鉴定电泳图,M:15000 DNA Marker。载体量:5 ng/20 μL反应体系,反应条件:50℃,15 min。结果显示YEASEN产品的克隆数更多,克隆阳性率与进口品牌相当。

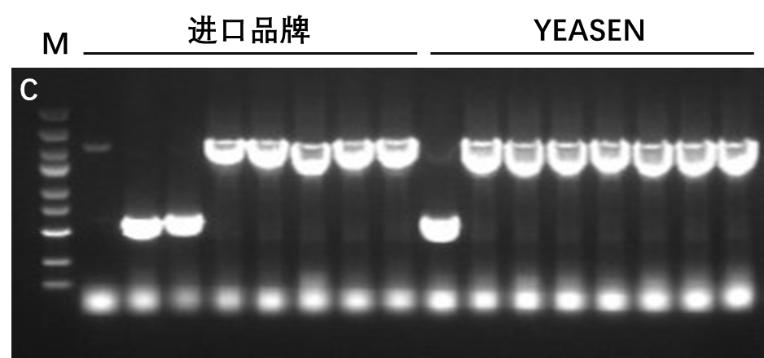
图3. Hieff Clone® Universal One Step Cloning Kit 进行四片段克隆。A-B:重组转化平板。载体(pLacZi,6.9 kb)和插入片段(0.5 kb、0.5 kb和1 kb)摩尔比为1:3。C:插入片段PCR鉴定电泳图,M:5000 DNA Marker。载体量:5 ng/20 μL反应体系,反应条件:50℃,15 min。结果显示YEASEN产品的克隆数更多,克隆阳性率也优于进口品牌。
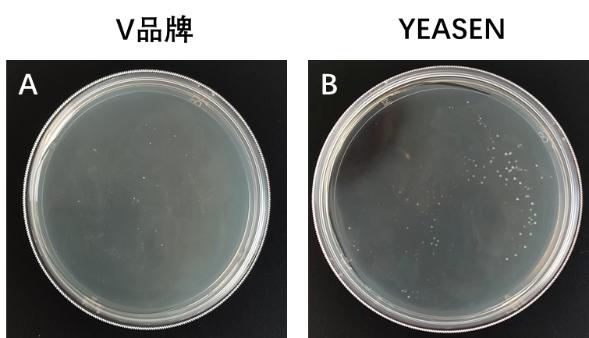

图4. Hieff Clone® Universal One Step Cloning Kit 进行六片段克隆。A-B:重组转化平板。载体(pGEX4T-1,5 kb)和插入片段(0.5 kb、0.5 kb、0.5 kb、0.5 kb、0.5 kb和1 kb)摩尔比为1:3。C:插入片段PCR鉴定电泳图,M:5000 DNA Marker。载体量:5 ng/20 μL反应体系,反应条件:50℃,30 min。结果显示YEASEN产品的克隆生长数和克隆阳性率远好于V品牌。
冰袋运输。-20℃保存,有效期1年。
[1] Tao R, Shi M, Zou Y, et al. Multicoloured fluorescent indicators for live-cell and in vivo imaging of inorganic mercury dynamics. Free Radic Biol Med. 2018;121:26-37. doi:10.1016/j.freeradbiomed.2018.04.562(IF:6.020)
[2] Guo Z, Long L, Ding S. Characterization of an L-Arabinose Isomerase from Bacillus velezensis and Its Application for L-Ribulose and L-Ribose Biosynthesis. Appl Biochem Biotechnol. 2020;192(3):935-951. doi:10.1007/s12010-020-03380-0(IF:2.277)





