Anti-Flag亲和纯化凝胶(分泌蛋白或膜蛋白)由高质量的鼠源IgG2b单克隆抗体(克隆号:3F5)与4%高度交联的琼脂糖凝胶通过共价偶联制备,本产品具有较高的Flag标签融合蛋白加载容量(至少为1.1 mg 蛋白/mL凝胶),杂蛋白非特异结合少,可用于带有Flag标签的融合蛋白(分泌蛋白或膜蛋白)纯化和免疫沉淀(IP)。
Anti-Flag亲和纯化凝胶(分泌蛋白或膜蛋白)可结合Met修饰的N端Flag融合蛋白(Met-FLAG–Protein),N端Flag融合蛋白(FLAG–Protein),C端Flag融合蛋白(Protein-FLAG)。
翌圣Anti-Flag亲和纯化凝胶(分泌蛋白或膜蛋白)储存在保护液(TBS,50%甘油,pH7.4,含有0.02%(w/v)叠氮钠)中,凝胶和保护液的比例为1:1,我司产品规格为实际凝胶的体积。
此外,我司还提供Anti-Flag亲和纯化凝胶(分泌蛋白)(Cat#20584ES,抗体克隆号:1A3), 尤其适用于带有Flag标签的分泌蛋白的纯化。
翌圣为您提供蛋白纯化实验整体解决方案,相关产品选购请参考:蛋白纯化系列产品-选购指南
产品信息
| 货号 | 20585ES03 / 20585ES08 / 20585ES25 / 20585ES60 |
| 规格 | 1 mL /5 mL /25 mL /100 mL |
注:为了方便客户使用1×Flag多肽洗脱,本产品包装搭配赠送1×Flag多肽(Cat#20572ES)。
基于1×Flag多肽(Cat#20572ES)不同规格分装,1 mL凝胶包装搭配5 mg多肽,其余凝胶规格均搭配为1 mL:1 mg比例的5 mg规格1×Flag多肽(Cat#20572ES)。
高特异性捕获:高质量的鼠源IgG2b单克隆抗体(克隆号:3F5)与4%高度交联的琼脂糖凝胶共价偶联,精准识别并结合带有Flag标签的跨膜蛋白,显著减少杂蛋白的非特异性结合,确保纯化后的跨膜蛋白具有高纯度。
高载量:即使跨膜蛋白表达量较低,其高加载容量(≥1.1 mg蛋白/mL凝胶)也能实现高效捕获。
温和洗脱:TBS+50%甘油缓冲液(pH 7.4)低温保存,凝胶活性稳稳的。搭配赠送Flag洗脱多肽,可避免对跨膜蛋白结构的破坏,适用于后续生物活性检测或结构解析。
产品性质
| 克隆号(Clone) | 3F5 |
| 亚型(Isotype) | Mouse IgG2b |
| 应用(Application) | 分泌蛋白或膜蛋白纯化, 免疫沉淀(IP) |
| 蛋白结合量(Protein) | ≥1.1 mg蛋白/mL凝胶 |
| 储存缓冲液(Buffer) | TBS,50%甘油,pH7.4,含有0.02%(w/v)叠氮钠 |
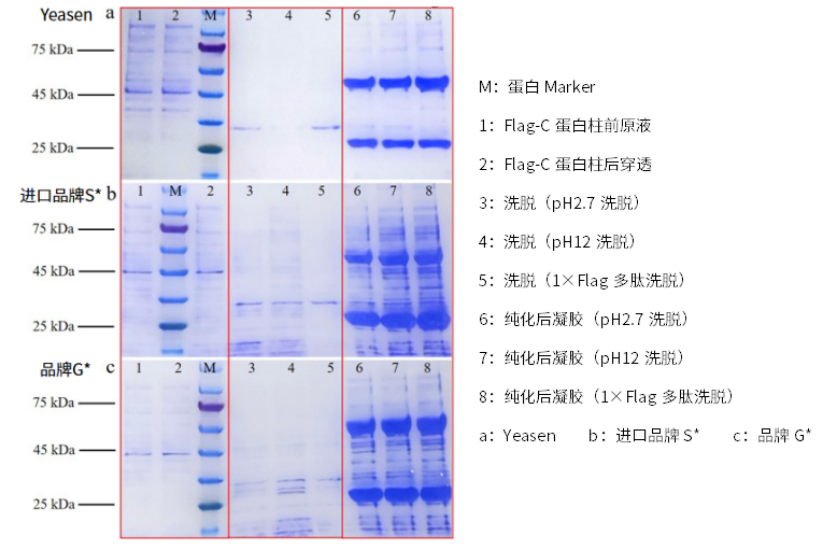
图1:Yeasen(a) PK进口品牌S*(b)、品牌G*(c)Anti-Flag凝胶纯化低表达量蛋白(比如膜蛋白)结果对比测试跑胶图
备注:在目的蛋白表达量极低的条件下(比如膜蛋白), Yeasen Anti-Flag亲和纯化凝胶(分泌蛋白或膜蛋白)(Cat#20585ES)得到的目的蛋白得率、纯度明显优于竞品,且使用Yeasen搭配赠送的1×Flag多肽(Cat#20572ES)洗脱效果更佳。
-25~-15℃保存,有效期1年。禁止在不含甘油的溶液中冻存!
[1] Lin J, Jiang X, Dong M, et al. Hepatokine Pregnancy Zone Protein Governs the Diet-Induced Thermogenesis Through Activating Brown Adipose Tissue. Adv Sci (Weinh). 2021;8(21):e2101991. doi:10.1002/advs.202101991(IF:16.806)
[2] Han L, Zhang F, Liu Y, et al. Uterus globulin associated protein 1 (UGRP1) binds podoplanin (PDPN) to promote a novel inflammation pathway during Streptococcus pneumoniae infection. Clin Transl Med. 2022;12(6):e850. doi:10.1002/ctm2.850(IF:11.492)
[3] Chen X, Duan Y, Qiao F, et al. A secreted fungal effector suppresses rice immunity through host histone hypoacetylation [published online ahead of print, 2022 May 20]. New Phytol. 2022;10.1111/nph.18265. doi:10.1111/nph.18265(IF:10.152)
[4] Chen Y, Yang L, Lu Y, et al. Up-regulation of NMRK2 mediated by TFE3 fusions is the key for energy metabolism adaption of Xp11.2 translocation renal cell carcinoma. Cancer Lett. 2022;538:215689. doi:10.1016/j.canlet.2022.215689(IF:8.679)
[5] Chen X, Li X, Li P, et al. Comprehensive identification of lysine 2-hydroxyisobutyrylated proteins in Ustilaginoidea virens reveals the involvement of lysine 2-hydroxyisobutyrylation in fungal virulence. J Integr Plant Biol. 2021;63(2):409-425. doi:10.1111/jipb.13066(IF:7.061)
[6] Tang C, Zhou Y, Sun W, et al. Oncopeptide MBOP Encoded by LINC01234 Promotes Colorectal Cancer through MAPK Signaling Pathway. Cancers (Basel). 2022;14(9):2338. Published 2022 May 9. doi:10.3390/cancers14092338(IF:6.639)
[7] Zheng G, Jiang C, Li Y, et al. TMEM43-S358L mutation enhances NF-κB-TGFβ signal cascade in arrhythmogenic right ventricular dysplasia/cardiomyopathy. Protein Cell. 2019;10(2):104-119. doi:10.1007/s13238-018-0563-2(IF:6.228)
[8] Chen X, Tang J, Pei Z, et al. The 'pears and lemons' protein UvPal1 regulates development and virulence of Ustilaginoidea virens. Environ Microbiol. 2020;22(12):5414-5432. doi:10.1111/1462-2920.15284(IF:4.933)






