 从Tn5结构来看如何利用Tn5进行文库构建
从Tn5结构来看如何利用Tn5进行文库构建
在NGS领域,tn5酶算是明星了,不管是表观建库如ATAC-seq、CUT&Tag还是在极速建库领域抑或是一步法建库技术等等的应用都颇为广泛,完全是主角的存在。那tn5酶是怎么完成建库的呢?各位看官请听小翌详说。
原始Tn5酶是由两个1.5 kb的IS50插入序列夹带的抗生素耐药区组成,IS50L和IS50R。它是通过多步骤酶切-粘贴机制行使功能。具体为:两分子tn5转座酶单体首先结合到IS50元件末端的两个19 bp区域(OE序列和IE序列),然后通过二聚体形成突触复合体;转座酶促进重组的三个核心步骤
1.这些蛋白可以识别移动元件末端的特定DNA序列,并将它们配对形成突触复合体;
2.这些蛋白在元件的每一端切割DNA,将元件的3'OH端从嵌入的DNA中解放出来;
3.这些蛋白促进新的DNA位点上的末端的两个磷酸二酯键被攻击,从而将元件的基因组连接到新的DNA片段。水在裂解阶段扮演亲核试剂的攻击角色,而元件的3 '羟基在DNA连接阶段(称为DNA链转移)扮演亲核试剂的角色[1]。
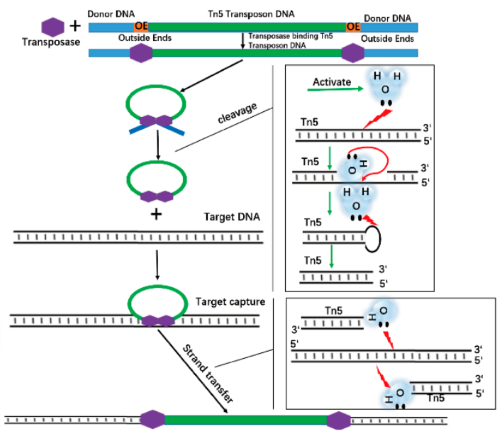
图1.Tn5转座机制[2]
Tn5发展到现在,人们已经能够利用Tn5进行体外酶切实验,也是我们现在利用Tn5酶来进行文库构建的方式。研究者发现,体外Tn5实验,只需要核心序列(ME:CTGTCTCTTATACACATCT)、Tn5转座酶以及Mg2+就能够行使Tn5 ”剪切-复制”功能。因而利用这种原理,科学家们将含测序接头序列一致的序列添加到ME序列中,在转座酶“剪切-复制”时,将ME序列插入靶DNA序列的同时,加上测序序列,从而在后续建库扩增过程中,实现一步法PCR建库就能获得完整的用于测序的文库。
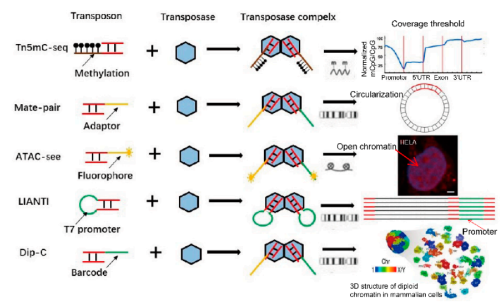
图2.含不同测序引物的tn5酶应用场景[2]
当然,Tn5酶虽然有这么强的优势,但是也有一定的缺陷,就是Tn5酶在“剪切”位点末端,具有9bp的碱基偏好性。那看到这里,可能会有人问,既然有碱基偏好性,Tn5酶是不是像常用的限制性内切酶一样有识别位点呢?为什么我们一直说Tn5酶是随机切割呢?实际上,Tn5酶确实是有识别位点,但是识别位点并非像限制性内切酶一样序列特异。目前共识的Tn5/IS50目标位点为A-GNTYWRANC-T。
当然,看到这里,可以还是有人会问,那我们做像ATAC、CUT&tag这样的表观实验,如果Tn5有目标识别序列,是不是效果就不太好?这里又得说到Tn5转座的另一个特性,就是它会优先整合到主动转录或高度超卷曲的DNA区域中,这种特性就与序列特异性无关,而是与靶标的拓扑结构有关[3]。
讲了这么多的原理,那在Tn5建库过程中,含有ME序列和接头序列的包埋序列,是如果进行建库的呢?
我们以常用的含Illumina测序adapter的ME为例,来给大家详细讲解吧。
首先,隆重出场的是转座酶复合体。转座酶复合体是由两分子的Tn5转座酶加两端DNA序列,具体情况见下图:

图3.Tn5转座酶结构
转座酶复合体组合后,我们就可以进行文库构建了,Tn5转座复合体进行“剪切-复制”的过程中,会在靶DNA处产生一个9bp的gap,在文库构建的PCR阶段,需要先进行72℃的延申步骤来补平gap,具体步骤见下图:
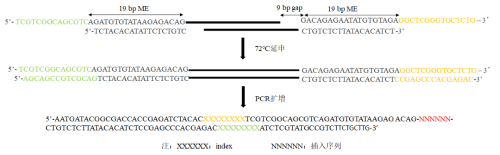
图4.Tn5文库构建流程
大家对Tn5酶进行文库构建是否明白了呢?
[1] Rice P A , Baker T A . Rice PA, Baker TA. Comparative architecture of transposase and integrase complexes. Nat Struct Biol 8: 302-307[J]. Nature Structural Biology, 2001, 8(5):302-307.
[2] Li N , Jin K , Bai Y , et al. Tn5 Transposase Applied in Genomics Research[J]. International Journal of Molecular Sciences, 2020, 21(21):8329.
[3]Goryshin, Igor Y , Miller, et al. Tn5/IS50 target recognition.[J]. Proceedings of the National Academy of Sciences of the United States of America, 1998.


