Plant Tissue PCR Kit (With Dye) 植物组织直接PCR试剂盒
产品介绍
Plant Tissue Direct PCR Kit (With Dye)植物组织直接PCR试剂盒是一款可直接对不同类型植物叶片进行PCR扩增的试剂盒,适应性广、稳定性强。试剂盒采用独特的裂解缓冲液体系,可以快速的裂解多种植物样品并释放出基因组DNA,不需要除去蛋白、RNA或次生代谢产物等,即可将释放出的基因组DNA作为模板直接用于PCR反应。此外,样品使用量少,低至1 mm植物叶片即可进行实验。
本试剂盒中提供的2× Plant Master Mix具有很强的扩增兼容性,能直接以待测样品裂解液为模板,进行高效特异性扩增。该试剂为2倍浓缩PCR反应混合液,包含了用于PCR扩增除模板和引物外的所有组分,大大简化操作过程,降低污染几率。且含有示踪染料,PCR产物可直接电泳。
该试剂盒可用于转基因植株鉴定、植物基因分型等。
产品特色
- 适应性广、稳定性强
应用案例
- 多类型植物样本验证
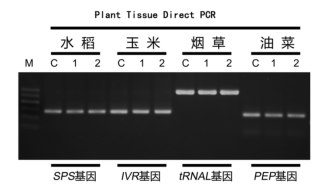
不同类型植物叶片直扩结果。M:100 bp DNA ladder。C:相应植物纯化基因组DNA为模板。1-2:叶片组织裂解产物为模板。循环数:30个循环。
存储条件
1. 试剂10187-A【Buffer P1】,置于2-8℃保存。有效期1年。
2. 试剂10187-B【Buffer P2】,中和裂解产物,利于更长时间保存样本,置于2-8℃保存。有效期1年。
3. 试剂10187-C【2 × Plant Master Mix】,-25~-15℃保存,避免反复冻融。有效期1年。
试剂盒有效期1年。
COA
联系我们





