动物组织直接PCR试剂盒是一款可直接对不同动物组织进行PCR扩增的试剂盒,适应性广、稳定性强、操作简易。本试剂盒采用独特的裂解缓冲液体系,可以快速的裂解多种动物组织样品并释放出基因组DNA,如昆虫足翅、鼠尾、鼠趾、动物皮肤和内脏等。裂解产物可以用于DNA提取纯化、也可以直接用于PCR反应、也可以在-20℃或以下温度条件下长期保存备用。
本试剂盒中提供的2×Tissue Direct PCR Mix (With Dye)具有很强的扩增兼容性,不需要额外采用纯化提取试剂去除裂解产物中的各种残骸杂质,能直接以待测样品裂解液为模板,进行高效特异性扩增。该试剂为2倍浓缩PCR反应混合液,包含了用于PCR扩增除模板和引物外的所有组分,大大简化扩增步骤的操作过程,降低污染机率。
该试剂盒可用于动物基因扩增检测、转基因动物基因型鉴定等。
- 直接:无需进行费时而昂贵的DNA纯化
- 快速:10min完成模板制备,最少50min完成PCR反应
- 简便:样品无需剪碎或研磨即可完成裂解,PCR Mix为预混液形式,减少加样步骤
- 节省:材料用量少
- 高通量:可在96孔板中完成裂解反应
- 基因敲除小鼠基因型鉴定
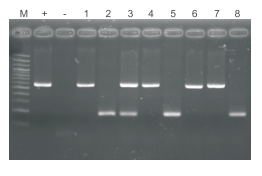
动物组织直接PCR试剂盒检测基因敲除动物组织直扩结果。M:100bp DNA ladder。1-8:以裂解产物为模板。+:以50ng纯化基因组DNA为模板。﹣:以去离子水为模板。循环数:35个循环。单条带(580bp):敲除动物纯合子基因组。单条带(180bp):野生型基因组。两条带(580bp/180bp):敲除动物杂合子基因组。
1. 试剂10184-A【Lysis Buffer】为动物组织裂解缓冲液,建议保存于2-8℃。
2. 试剂10184-B【Proteases】为动物组织裂解剂,使用时请勿长久开盖,建议保存于-25~-15℃,避免反复冻融。
3. 试剂10184-C【2×Tissue Direct PCR Mix (With Dye)】,建议保存于-25~-15℃,避免反复冻融。
4. 试剂10184-D【5×PCR Enhancer】,建议保存于-25~-15℃,避免反复冻融。
试剂盒有效期1年。
[1] Chen P, Zhou J, Wan Y, et al. A Cas12a ortholog with stringent PAM recognition followed by low off-target editing rates for genome editing. Genome Biol. 2020;21(1):78. Published 2020 Mar 25. doi:10.1186/s13059-020-01989-2(IF:10.806)
[2] Pan Y, Fang G, Wang Z, et al. Chromosome-level genome reference and genome editing of the tea geometrid. Mol Ecol Resour. 2021;21(6):2034-2049. doi:10.1111/1755-0998.13385(IF:7.090)
[3] Sun X, Zhang K, Gu J, et al. The biological characters of Bmelav-like genes in the development of Bombyx mori. Insect Mol Biol. 2021;30(1):9-17. doi:10.1111/imb.12668(IF:2.533)





