本试剂盒可直接快速地对小鼠组织(如鼠尾、鼠耳、鼠趾、肌肉等)样本进行PCR扩增,具有极强的样本兼容性。本试剂盒配备了强力的裂解缓冲液,可以快速裂解样品,释放基因组DNA。裂解液可以直接加入到PCR反应体系中,无需精提纯化,操作方便。此外,本试剂盒对样品投入量要求低,5 mg小鼠组织或1-5 mm鼠尾即可进行实验。
本试剂盒提供的2× Mouse Direct PCR Mix为2倍浓度的热启动PCR反应液,包含了用于PCR扩增除模板和引物外的所有组分,大大简化操作过程,降低污染几率。且含有示踪染料,PCR产物可直接电泳。
该试剂盒可用于转基因鉴定、小鼠基因分型等。
- 直接:无需进行费时而昂贵的DNA纯化
- 快速:10min完成模板制备,最少50min完成PCR反应
- 简便:样品无需剪碎或研磨即可完成裂解,PCR Mix为预混液形式,减少加样步骤
- 节省:材料用量少
- 高通量:可在96孔板中完成裂解反应
- 更快速:基因释放充分
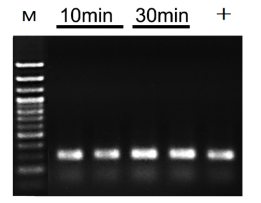
小鼠组织直接PCR试剂盒不同裂解时间直扩结果。M:100bp DNA ladder。+:以50 ng纯化基因组DNA为模板。循环数:35个循环。
- 更彻底:基因释放充分
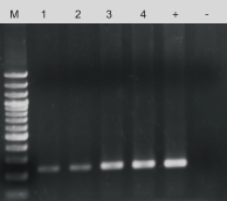
鼠尾经不同裂解方式处理后的直扩结果。检测基因:SOX21。M:100 bp DNA ladder。1-2:以常规碱裂解方式处理裂解产物为模板。3-4:以小鼠组织直接PCR试剂盒裂解产物为模板。+:以50 ng纯化基因组DNA为模板。﹣:以去离子水为模板。循环数:35个循环。
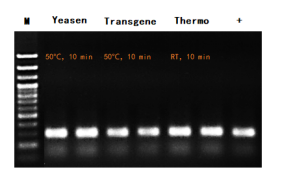
鼠尾经不同品牌同类产品裂解处理后的直扩结果。检测基因:SOX21。M :100 bp DNA ladder。+ :以50 ng纯化基因组DNA为模板。循环数:35个循环。
1. 试剂10185-A【Buffer ML】,2-8℃保存。如长时间未使用,请分装冻存,避免交叉污染。
2. 试剂10185-B【Buffer MT】,-25~-15℃保存,避免反复冻融。
3. 试剂10185-C【2× Mouse Direct PCR Mix】,-25~-15℃保存,避免反复冻融。
试剂盒有效期1年。
[1] Luo J, Yang Q, Zhang X, et al. TFPI is a colonic crypt receptor for TcdB from hypervirulent clade 2 C. difficile. Cell. 2022;185(6):980-994.e15. doi:10.1016/j.cell.2022.02.010(IF:41.584)
[2] Zhao J, Chen J, Li YY, Xia LL, Wu YG. Bruton's tyrosine kinase regulates macrophage‑induced inflammation in the diabetic kidney via NLRP3 inflammasome activation. Int J Mol Med. 2021;48(3):177. doi:10.3892/ijmm.2021.5010(IF:4.101)





