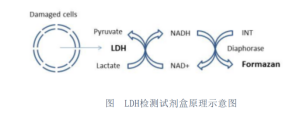
乳酸脱氢酶细胞毒性检测试剂盒(LDH Cytotoxicity Assay Kit),也称乳酸脱氢酶检测试剂盒(LDH Assay Kit)或乳酸脱氢酶释放检测试剂盒(LDH Release Assay Kit),是一种基于diaphorase催化的INT显色反应,通过比色法检测细胞毒性时释放的乳酸脱氢酶活性或检测其它样品中的乳酸脱氢酶活性的试剂盒。细胞凋亡或坏死而造成的细胞膜结构的破坏会导致细胞浆内的酶释放到培养液里,其中包括酶活性较为稳定的乳酸脱氢酶(lactate dehydrogenase, LDH)。通过检测从质膜破裂的细胞中释放到培养液中的LDH的活性,就可以实现对细胞毒性的定量分析。LDH释放被看做细胞膜完整性的重要指标,并被广泛用于细胞毒性检测。LDH释放被认为是以前使用放射性的51Cr标记细胞,随后通过51Cr释放进行细胞膜完整性检测的安全有效的替代方法。本试剂盒的基本原理是,在乳酸脱氢酶的作用下,NAD+被还原生成NADH,NADH和INT (2-p-iodophenyl-3-nitrophenyl tetrazolium chloride)被硫辛酰胺脱氢酶(diaphorase)催化反应生成NAD+和强生色物甲臜(formazan),在490 nm波长下产生吸收峰,从而通过比色来定量检测细胞培养液、细胞裂解液等样品中乳酸脱氢酶的活性。吸光度与乳酸脱氢酶活性成线性正相关。该酶联反应原理的示意图如下:
即用、便捷。
-25~-15℃保存,避光保存,有效期1年。
[1] Yu L, Liu X, Ye X, et al. Monoclonal Antibodies against Zika Virus NS1 Protein Confer Protection via Fcγ Receptor-Dependent and -Independent Pathways. mBio. 2021;12(1):e03179-20. Published 2021 Feb 9. doi:10.1128/mBio.03179-20(IF:7.867)
[2] Guo G, Zhou H, Wang Q, et al. Nano-layered magnesium fluoride reservoirs on biomaterial surfaces strengthen polymorphonuclear leukocyte resistance to bacterial pathogens. Nanoscale. 2017;9(2):875-892. doi:10.1039/c6nr07729c(IF:7.760)
[3] Liao L, Jiang C, Chen J, et al. Synthesis and biological evaluation of 1,2,4-triazole derivatives as potential neuroprotectant against ischemic brain injury. Eur J Med Chem. 2020;190:112114. doi:10.1016/j.ejmech.2020.112114(IF:5.573)
[4] Wang D, Yuan T, Liu J, et al. ATG16L2 inhibits NLRP3 inflammasome activation through promoting ATG5-12-16L1 complex assembly and autophagy [published online ahead of print, 2022 Apr 15]. Eur J Immunol. 2022;10.1002/eji.202149764. doi:10.1002/eji.202149764(IF:5.532)
[5] Dai B, Fan M, Huang X, et al. Shuanghua decoction exerts anticancer activity by activating NLRP3 inflammasome via ROS and inhibiting NF-κB signaling in hepatocellular carcinoma cells. Phytomedicine. 2022;103:154249. doi:10.1016/j.phymed.2022.154249(IF:5.340)
[6] Niu X, Lin L, Liu L, Yu Y, Wang H. Antifungal activity and molecular mechanisms of mulberrin derivatives against Colletotrichum gloeosporioides for mango storage [published online ahead of print, 2022 Jun 20]. Int J Food Microbiol. 2022;378:109817. doi:10.1016/j.ijfoodmicro.2022.109817(IF:5.277)
[7] Cai B, Liao C, He D, et al. Gasdermin E mediates photoreceptor damage by all-trans-retinal in the mouse retina. J Biol Chem. 2022;298(2):101553. doi:10.1016/j.jbc.2021.101553(IF:5.157)
[8] Lin CX, Gu JL, Cao JM. The acute toxic effects of platinum nanoparticles on ion channels, transmembrane potentials of cardiomyocytes in vitro and heart rhythm in vivo in mice. Int J Nanomedicine. 2019;14:5595-5609. Published 2019 Jul 22. doi:10.2147/IJN.S209135(IF:4.471)
[9] Hu T, Xu H, Wang C, Qin H, An Z. Magnesium enhances the chondrogenic differentiation of mesenchymal stem cells by inhibiting activated macrophage-induced inflammation. Sci Rep. 2018;8(1):3406. Published 2018 Feb 21. doi:10.1038/s41598-018-21783-2(IF:4.122)
[10] Yang Y, Wang X, Gao Y, Wang H, Niu X. Insight into the Dual inhibitory Mechanism of verbascoside targeting serine/threonine phosphatase Stp1 against Staphylococcus aureus. Eur J Pharm Sci. 2021;157:105628. doi:10.1016/j.ejps.2020.105628(IF:3.616)
[11] Wang F, Liu J, Wang D, Yao Y, Jiao X. Knockdown of circ_0007290 alleviates oxygen-glucose deprivation-induced neuronal injury by regulating miR-496/PDCD4 axis. Metab Brain Dis. 2022;37(3):807-818. doi:10.1007/s11011-021-00900-7(IF:3.584)
[12] Su Q, Wang J, Liu F, Zhang Y. Blocking Parkin/PINK1-mediated mitophagy sensitizes hepatocellular carcinoma cells to sanguinarine-induced mitochondrial apoptosis. Toxicol In Vitro. 2020;66:104840. doi:10.1016/j.tiv.2020.104840(IF:2.959)
[13] Lv H, Fang T, Kong F, et al. Dryocrassin ABBA ameliorates Streptococcus pneumoniae-induced infection in vitro through inhibiting Streptococcus pneumoniae growth and neutralizing pneumolysin activity. Microb Pathog. 2021;150:104683. doi:10.1016/j.micpath.2020.104683(IF:2.914)
[14] Liu XD, Li YG, Wang GY, et al. Metformin protects high glucose‑cultured cardiomyocytes from oxidative stress by promoting NDUFA13 expression and mitochondrial biogenesis via the AMPK signaling pathway. Mol Med Rep. 2020;22(6):5262-5270. doi:10.3892/mmr.2020.11599(IF:2.100)
[15] Wang T, Zhu L, Liu H, Yu G, Guo Y. Picroside II Protects SH-SY5Y Cells From Autophagy and Apoptosis Following Oxygen Glucose Deprivation/Reoxygen Injury by Inhibiting JNK Signal Pathway. Anat Rec (Hoboken). 2019;302(12):2245-2254. doi:10.1002/ar.24214(IF:1.329)





