HisSep Ni-NTA MagBeads His标签蛋白纯化磁珠
产品介绍
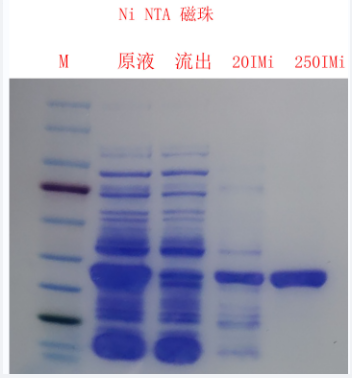
His-tag蛋白纯化磁珠是一种高容量的新型磁性微球产品,用于快速、高效的纯化His标签融合蛋白。磁珠在磁场作用下直接从生物样品中可一步纯化出高达95%纯度的目的蛋白,极大的简化了纯化工艺和提高纯化效率。将含有His标签蛋白的细胞裂解物添加到MagBeads中,让蛋白质与其充分结合,然后可从磁珠中洗脱分离出目的蛋白。
与传统柱层析方法相比,使用磁珠纯化His标签蛋白无需控制上样流速和多次离心样品,也不需要昂贵的层析和离心设备。样品与磁珠的结合以及目的蛋白与磁珠的分离简单、快捷,而且更容易实现高通量、自动化的蛋白纯化方法。适合科研和工业客户高通量地进行组氨酸标签蛋白的纯化。
该磁珠以4%琼脂糖凝胶为基质通过化学方法偶联了四配位的氮川三乙酸(NTA),螯合镍离子(Ni2+)后,可以形成非常稳定的八面体结构,镍离子处于八面体的中心,这样的结构很有效的保护了镍离子免受小分子的进攻更加稳定。
His标签蛋白纯化磁珠广泛适用于细菌、酵母、昆虫和哺乳动物细胞等分泌或胞内表达的可溶性组氨酸标签蛋白,也可用于变性蛋白的纯化(包涵体需变性后再进行纯化)。
翌圣为您提供蛋白纯化实验整体解决方案,相关产品选购请参考:蛋白纯化系列产品-选购指南
产品特色
| 基质 | 磁性琼脂糖微球 |
| 载量 | > 40 mg 6×His-tagged protein/mL磁珠 |
| 粒径 | 30-100 μm |
| 磁珠浓度 | 磁珠悬浮于保护液中,含量为20%(V/V) |
| 储存缓冲液 | 含20%乙醇的1×PBS |
存储条件
冰袋运输。4℃长期储存,有效期2年。
COA
已发表文献
- Xu G, Han S, Huo C, et al. Signaling specificity in the c-di-GMP-dependent network regulating antibiotic synthesis in Lysobacter. Nucleic Acids Res. 2018;46(18):9276-9288. doi:10.1093/nar/gky803(IF:11.561)
- Zhang L, Dong C, Wang J, et al. Predation of oomycetes by myxobacteria via a specialized CAZyme system arising from adaptive evolution. ISME J. 2023;17(7):1089-1103. doi:10.1038/s41396-023-01423-y(IF:11.0)
联系我们