MolPure® Plasmid Mini Kit 采用 MolPure® DNA Column P3 和新型的溶液体系,使用常规碱裂解法分离质粒 DNA。提取过程中不需要用到有毒的酚氯仿等有机物抽提,也不需要用到耗时的异丙醇或乙醇沉淀。试剂盒内的 MolPure® DNA Column P3 可 特异性吸附质粒 DNA,不吸附蛋白质、多糖和其它非核酸类物质,具有高效、快速、方便等特点。提取到的质粒 DNA 纯度高, 可直接用于后续酶切、转化、测序等实验。
样本范围广:适用于常规小量质粒提取,单次可提取 2~6 mL 菌液。
DNA纯度高:无蛋白质和RNA污染,可直接用于酶切、转化、测序等实验。
DNA得率高:柱子最大可吸附 60 μg 质粒DNA。
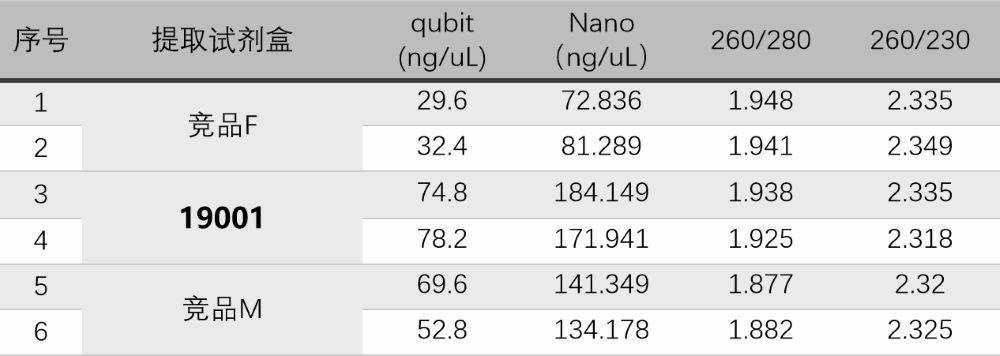

图1:取相同量的菌液进行质粒提取,提取得率:19001>竞品M>竞品F
PartI 组分-25~-15℃保存;Part II 组分室温保存。有效期2年。
[1] Zhang C, Liu Y, Zhang T, Lv C, Zang J, Zhao G. Structural comparison between the DNA-protective ability of scallop and shrimp ferritin from iron-induced oxidative damage. Food Chem. 2022;386:132827. doi:10.1016/j.foodchem.2022.132827(IF:7.514)
[2] Hei H, Gao J, Dong J, et al. BK Knockout by TALEN-Mediated Gene Targeting in Osteoblasts: KCNMA1 Determines the Proliferation and Differentiation of Osteoblasts. Mol Cells. 2016;39(7):530-535. doi:10.14348/molcells.2016.0033(IF:2.670)





