MolPure® Magnetic Plasmid Mini Kit 磁珠法质粒小量提取试剂盒
产品介绍
MolPure® Magnetic Plasmid Mini Kit采用碱裂解法裂解细胞,通过独特的磁珠和精心优化的缓冲体系从菌体中提取纯化高质量的质粒DNA,提取过程中不需要用到有毒的酚氯仿等有机物。本试剂盒适用于提取1-5 mL过夜培养的大肠杆菌,质粒提取得率和质量与质粒拷贝数、宿主菌种类以及细菌培养条件等因素相关。从2 mL过夜培养的菌液中一般能够获得8-12 μg的高质量质粒DNA。本试剂盒提取到的质粒DNA可直接用于后续酶切、转化和测序等实验。
产品特色
得率高、纯度好:采用独特的磁珠,能快速吸附和纯化溶液中的质粒。
效率高:菌体裂解后,可高效地与液体工作站或全自动核酸提取仪配套使用,以进行快速、大样本量的提取。
安全性好:提取过程安全,不涉及有毒的酚、氯仿、β-巯基乙醇等有机溶剂
应用案例
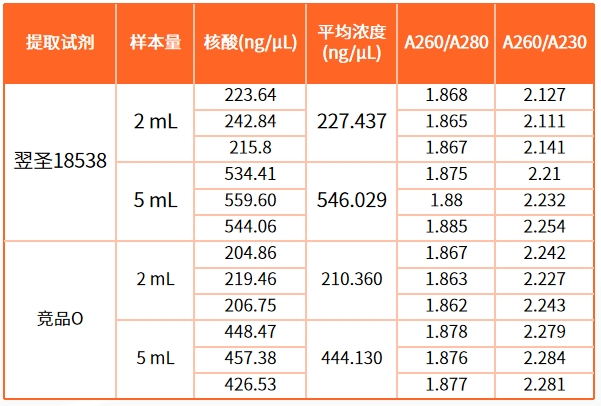
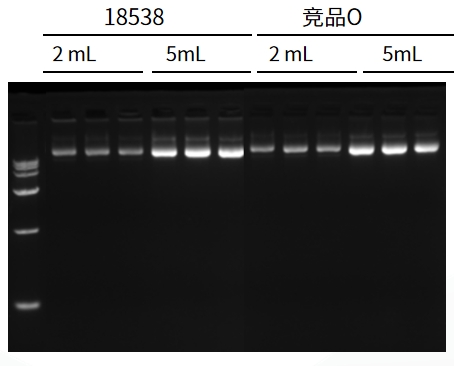
图:分别使用翌圣18538和竞品O按照各自流程提取pUC19质粒,70 μL洗脱体积,对提取产物进行浓度测定,结果显示:18538得到的产物浓度高于竞品O,D260/280和D260/230比值相当。
存储条件
1.PartⅠ冰袋运输,-25~-15℃ 保存,有效期18个月;
2.PartⅡ室温运输,室温保存,有效期18个月。
COA
相关产品
联系我们





