板式预混版链特异RNA建库试剂盒,适配自动化移液工作站,即撕即用。手动建库也更便捷。
Hieff NGS® EvoMax RNA Library Prep Kit(dUTP)是兼容Illumina和MGI双平台的链特异性 RNA测序文库构建试剂盒,本产品有常规管式和预装板式两种规制,预装板式无需手动配制或分装,可直接适配自动化上机建库,使用更为便捷。试剂盒包含RNA片段化试剂,反转录试剂,链特异性ds-cDNA合成试剂,以及文库扩增试剂。可以衔接mRNA纯化试剂盒或rRNA去除试剂盒构建测序文库。本产品优化了逆转录模块,无需放线菌素D便可获得高链特异性文库,更大程度的保证了实验人员安全。所有试剂都经过严格的质量控制和功能验证,最大程度上保证了文库构建的稳定性和重复性。
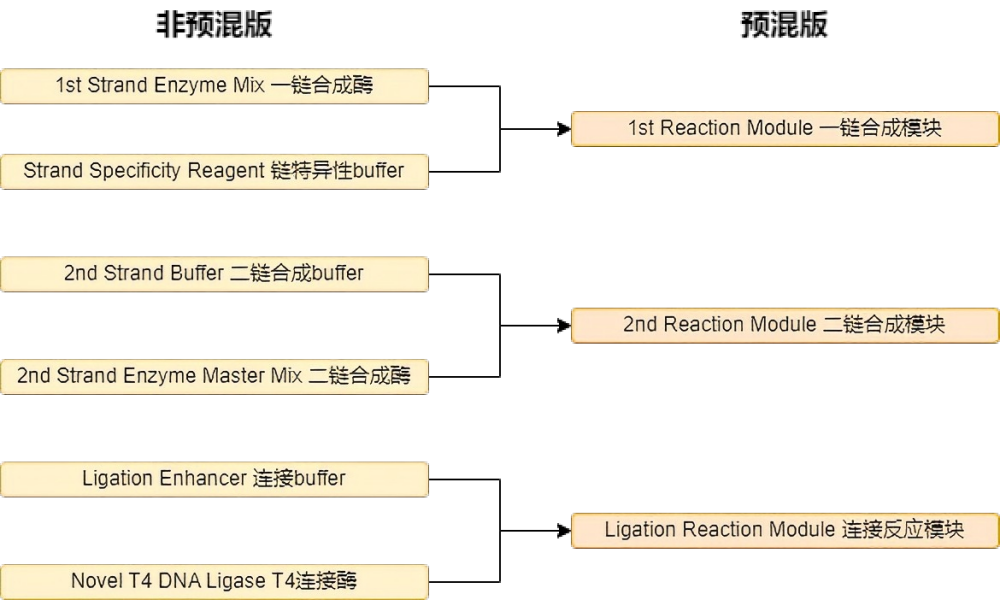
- 预混版本试剂:酶和buffer预混,试剂组分减少。
- 安全且无需避光,链特异性能更好:优化的逆转录酶保证试剂的链特异性,且试剂无需再额外避光处理。
- 板式预装试剂,即撕即用:储备MGISP-960脚本,适配各种自动化移液工作,即撕即用,使用方便。
1、预混与非预混试剂对比:预混试剂组分更少,操作更简便
预混版本相对于非预混版本试剂,组分减少一半,操作更便捷。
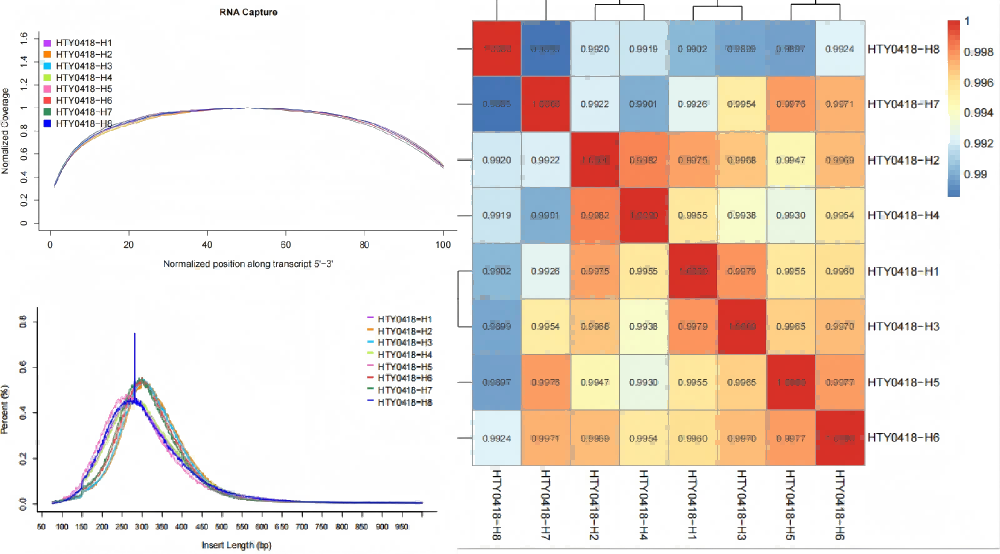
2、适配自动化移液工作站,结果准确,均一性好。

-25~-15℃保存。
[1] Tian S, Zhang B, He Y, et al. CRISPR-iPAS: a novel dCAS13-based method for alternative polyadenylation interference. Nucleic Acids Res. 2022;50(5):e26. doi:10.1093/nar/gkac108(IF:19.160)
[2] Lin Z, Luo P, Lin X, et al. Effects of a sulfated glycosaminoglycan from Sepia esculenta ink on transcriptional and metabolic profiles of Saccharomyces cerevisiae. Carbohydr Polym. 2022;276:118715. doi:10.1016/j.carbpol.2021.118715(IF:10.723)
[3] Zhang Y, Wu T, Li F, et al. FGF19 Is Coamplified With CCND1 to Promote Proliferation in Lung Squamous Cell Carcinoma and Their Combined Inhibition Shows Improved Efficacy. Front Oncol. 2022;12:846744. Published 2022 Apr 7. doi:10.3389/fonc.2022.846744(IF:5.738)
[4] Yang J, Cui Y, Zhang X, et al. Maize PPR278 Functions in Mitochondrial RNA Splicing and Editing. Int J Mol Sci. 2022;23(6):3035. Published 2022 Mar 11. doi:10.3390/ijms23063035(IF:6.208)
[5] Hu P, Guo S, Yang S, et al. Stachytine Hydrochloride Improves Cardiac Function in Mice with ISO-Induced Heart Failure by Inhibiting the α-1,6-Fucosylation on N-Glycosylation of β1AR. Front Pharmacol. 2022;12:834192. Published 2022 Feb 8. doi:10.3389/fphar.2021.834192(IF:5.988)
[6] Lin Z, Luo P, Huang D, Wu Y, Li F, Liu H. Multi-omics based strategy for toxicity analysis of acrylamide in Saccharomyces cerevisiae model. Chem Biol Interact. 2021;349:109682. doi:10.1016/j.cbi.2021.109682(IF:5.168)
[7] Wu Z, Li H, Zhang Y, et al. Liver transcriptome analyses of acute poisoning and recovery of male ICR mice exposed to the mushroom toxin α-amanitin. Arch Toxicol. 2022;96(6):1751-1766. doi:10.1007/s00204-022-03278-2(IF:6.168)
[8] Liu S, Liu J, Wang Y, et al. Differentially expressed genes induced by β-caryophyllene in a rat model of cerebral ischemia-reperfusion injury. Life Sci. 2021;273:119293. doi:10.1016/j.lfs.2021.119293(IF:6.780)
[9] Zhao H, Tang X, Wu M, et al. Transcriptome Characterization of Short Distance Transport Stress in Beef Cattle Blood. Front Genet. 2021;12:616388. Published 2021 Feb 10. doi:10.3389/fgene.2021.616388(IF:4.772)
[10] Sun X, Lv W, Wang Y, et al. Mrgprb2 gene plays a role in the anaphylactoid reactions induced by Houttuynia cordata injection. J Ethnopharmacol. 2022;289:115053. doi:10.1016/j.jep.2022.115053(IF:5.195)
[11] Liu T, Zhang Y, Cao Y, et al. Optimization of oncolytic effect of Newcastle disease virus Clone30 by selecting sensitive tumor host and constructing more oncolytic viruses. Gene Ther. 2021;28(12):697-717. doi:10.1038/s41434-020-0145-9(IF:4.184)
[12] Zhong Y, Zhao W, Tang Z, et al. Comparative transcriptomic analysis of the different developmental stages of ovary in red swamp crayfish Procambarus clarkii. BMC Genomics. 2021;22(1):199. Published 2021 Mar 21. doi:10.1186/s12864-021-07537-x(IF:4.547)
[13] Liu Y, Han R, Zhou L, et al. Comparative performance of the GenoLab M and NovaSeq 6000 sequencing platforms for transcriptome and LncRNA analysis [published correction appears in BMC Genomics. 2022 Jan 26;23(1):81]. BMC Genomics. 2021;22(1):829. Published 2021 Nov 17. doi:10.1186/s12864-021-08150-8(IF:4.547)
[14] Zheng J, Tian J, Wang S, et al. Stachydrine hydrochloride suppresses phenylephrine-induced pathological cardiac hypertrophy by inhibiting the calcineurin/nuclear factor of activated T-cell signalling pathway. Eur J Pharmacol. 2020;883:173386. doi:10.1016/j.ejphar.2020.173386(IF:5.195)
[15] Yangchun G, Yufeng W, Dainan C, et al. Transcriptome analysis reveals decreased immunity under heat stress in Mauremys mutica. Aquaculture,Volume 531,2021,https://doi.org/10.1016/j.aquaculture .2020.735894(IF:5.135)
[16] Diao G, Huang J, Zheng X, et al. Prostaglandin E2 serves a dual role in regulating the migration of dendritic cells. Int J Mol Med. 2021;47(1):207-218. doi:10.3892/ijmm.2020.4801(IF:5.314)
[17] Huang X, Liang C, Yang H, et al. Curcumin induces apoptosis and inhibits the growth of adrenocortical carcinoma: Identification of potential candidate genes and pathways by transcriptome analysis. Oncol Lett. 2021;21(6):476. doi:10.3892/ol.2021.12737(IF:3.111)
[18] Wen X, Liu S, Cui M. Effect of BRCA1 on the Concurrent Chemoradiotherapy Resistance of Cervical Squamous Cell Carcinoma Based on Transcriptome Sequencing Analysis. Biomed Res Int. 2020;2020:3598417. Published 2020 Jun 21. doi:10.1155/2020/3598417(IF:3.246)
[19] Ding CY, Ma YM, Li B, et al. Identification and Functional Analysis of Differentially Expressed Genes in Myzus persicae (Hemiptera: Aphididae) in Response to Trans-anethole. J Insect Sci. 2022;22(1):3. doi:10.1093/jisesa/ieab094(IF:2.066)
[20] Qian D, Tian J, Wang S, et al. Trans-cinnamaldehyde protects against phenylephrine-induced cardiomyocyte hypertrophy through the CaMKII/ERK pathway. BMC Complement Med Ther. 2022;22(1):115. Published 2022 Apr 25. doi:10.1186/s12906-022-03594-1(IF:2.838)
[21] Liu QH, Wang ZY, Tang JW, et al. Comparative transcriptome analysis of diurnal alterations of liver glycogen structure: A pilot study. Carbohydr Polym. 2022;295:119710. doi:10.1016/j.carbpol.2022.119710(IF:10.723)
[22] Wei W, Li Y, Wang C, et al. Diterpenoid Vinigrol specifically activates ATF4/DDIT3-mediated PERK arm of unfolded protein response to drive non-apoptotic death of breast cancer cells. Pharmacol Res. 2022;182:106285. doi:10.1016/j.phrs.2022.106285(IF:10.334)
[23] Zhang S, Deng L, Zhao L, Wu C. Genome-wide binding analysis of transcription factor Rice Indeterminate 1 reveals a complex network controlling rice floral transition. J Integr Plant Biol. 2022;64(9):1690-1705. doi:10.1111/jipb.13325(IF:9.106)
[24] Zhao H, Wu M, Tang X, et al. RNA-seq Based Transcriptome Analysis Reveals The Cross-Talk of Macrophage and Adipocyte of Chicken Subcutaneous Adipose Tissue during The Embryonic and Post-Hatch Period. Front Immunol. 2022;13:889439. Published 2022 Jul 15. doi:10.3389/fimmu.2022.889439(IF:8.786)
[25] Yang W, Wang K., Xia S, et al. Coordinating High Yield and Superior Eating Quality of Rice: A Case Study of Hybrid Varieties Derived from Longke638S and Jing4155S. Agronomy 2022, 12, 1628. https://doi.org/10.3390/agronomy12071628(IF:3.949)
[26] Zhou X, Liu N, Jiang X, et al. A chromosome-scale genome assembly of Quercus gilva: Insights into the evolution of Quercus section Cyclobalanopsis (Fagaceae). Front Plant Sci. 2022;13:1012277. Published 2022 Sep 23. doi:10.3389/fpls.2022.1012277(IF:6.627)





