CelCulSF™ Insect Cell Culture Medium(Serum-free) 昆虫细胞无血清培养基
产品介绍
CelCulSFTM Insect Cell Culture Medium(Serum-free)培养基是无血清培养基,无血清无蛋白,不含任何动物源成分。适应于昆虫细胞(Sf 9、High Five等)悬浮驯化及规模化无血清悬浮培养,支持昆虫细胞快速高密度扩增及高效表达蛋白产品。 可用于新冠疫苗、VLP 等产品研发和生产过程,支持从研发至规模化生产。
产品特色
1.无动物源、无蛋白、完全无血清;
2.支持生物反应器大规模放大培养工艺,支持批次、流加及灌流培养模式;
3.支持昆虫细胞悬浮高密度培养及杆状病毒在昆虫细胞中的高效表达。
应用案例
1、培养效果好、支持高密度培养
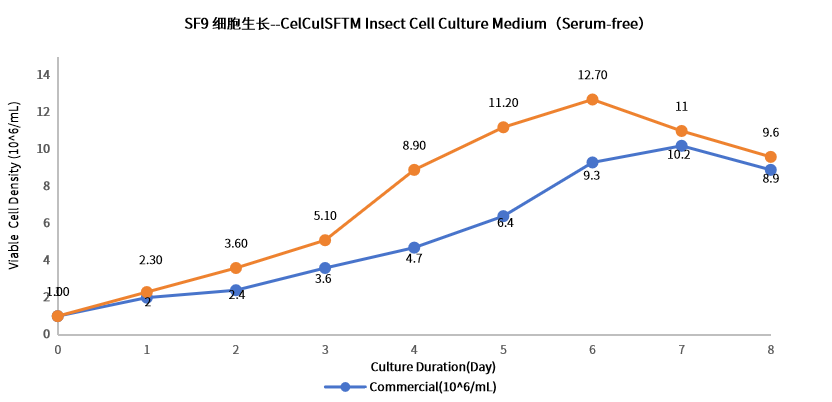
Insect细胞培养基批次培养PVCD能达到12E6 cells/ml以上(SF9)适用于杆状病毒扩增表达;可支持不同工艺规模放大培养;可支持批次培养,灌流培养,满足不同工艺要求。
存储条件
冰袋运输。2~8℃,避光保存,有效期1年。
COA
相关产品
联系我们





