超氧化物岐化酶(Superoxide Dismutase, SOD)能催化超氧化物阴离子发生岐化作用,生成过氧化氢(H2O2)和氧气(O2),是生物体内一种重要的抗氧化酶。
目前有多种SOD活性测定方法,其中NBT(氮蓝四唑)法和细胞色素C法都是常用的检测方法。但WST-8法更为先进,稳定性更好、灵敏度更高。其基本检测原理是:
黄嘌呤氧化酶(Xanthine Oxidase)催化产生超氧化物阴离子,该超氧化物阴离子可以与WST-8反应产生水溶性的甲臜(formazan)产物,而SOD可以抑制上述反应。通过分析甲臜产物OD值,可计算SOD的酶活力,检测原理图如下:
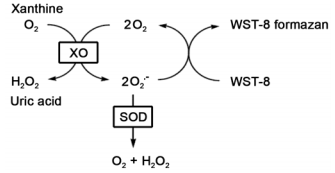
本试剂盒可以检测细胞或组织匀浆液上清、全血、红细胞抽提物、血清等多种生物样品中的SOD活性。按照试剂盒提供使用步骤操作,1个试剂盒可供100次检测。适合用于高通量筛选研究。
产品优势
1)WST-8反应产物是稳定的水溶性产物;
2)WST-8法可以通过检测单个时间点的吸光值测定SOD活力;
3)WST-8法测定时最大抑制百分率可以接近100%;
4)不受样品中过氧化氢的干扰,本试剂盒通过添加适量过氧化氢酶等特殊方法,有效去除常规样品中过氧化氢的干扰。
产品组分
| 组分编号 | 组分名称 | 组分规格 |
| 50105-A | SOD Assay Buffer SOD检测缓冲液 | 50 mL |
| 50105-B | WST-8 | 800 µL |
| 50105-C | Enzyme Solution 酶溶液 | 100 µL |
| 50105-D | 40×Initial Solution 40×反应启动液 | 60 µL |
| 50105-E | SOD样品制备液 | 50 mL |
注意事项
1)待测样品可-70℃保存一个月,避免反复冻融导致SOD部分失活;
2)细胞或组织等样品制备时不能采用含有Triton X-100等去垢剂的溶液,会干扰检测;
3)抗氧化物会对本试剂盒的检测产生干扰,例如0.1 mM ascorbic acid,5 mM GSH都会使测定出来的吸光度显著升高。如果设置了使用说明中的空白对照3,就可以消除样品中的抗氧化物的干扰。
4)为了您的安全和健康,请穿实验服并戴一次性手套操作。
5)本产品仅作科研用途!
使用方法
1.样品的制备
① 细胞样品
1000-2000 g,4℃离心10 min收集细胞,预冷PBS或生理盐水洗涤1-2次。SOD样品制备(按每1x106个细胞添加100~200 µL的SOD样品制备液制备并适当来回吹打使其充分裂解细胞),随后4℃、12000g离心5 min,取上清待测。
② 组织样品
动物解剖前用生理盐水(0.9% NaCl,含有0.16 mg/mL肝素钠)灌流彻底清除红细胞及血块,取适量的组织样品。于冰浴或是4℃环境中匀浆处理组织进行SOD样品制备(按每10 mg组织添加100 µL的SOD样品制备液)。 随后12000 g,4℃离心5 min,取上清待测。
③ 血浆或红细胞样品
用抗凝管收集血液,颠倒混匀。4℃,600 g离心10 min,移取上清至新的1 mL离心管中,适量生理盐水稀释后即可作为血浆样本进行检测。红细胞样品可以参考步骤① 细胞样品的制备方法,或其他不含Triton X-100等去垢剂的样品制备方法。【注】:a. 上述样品准备完毕后可以用BCA蛋白浓度测定试剂盒(Yeasen 20201)测定蛋白浓度。通常10-20 µg蛋白的细胞或组织匀浆液样品中的SOD平均活力约1个活力单位左右(不同细胞和组织的差异会比较大,该活力范围仅作参考)。每种样品准备20-100 µg蛋白量通常已经足够用于后续检测。b. 根据蛋白浓度和预计的蛋白使用量,用本试剂盒提供的SOD检测缓冲液适当稀释样品。例如,小鼠肝脏组织10%匀浆液(组织和匀浆液的重量比为10%)上清,通常需要稀释10-100倍。c. 准备好的样品如果当天测定,可以冰浴保存;如果当天不能完成测定,于-80℃冻存可保存至少1个月。但建议尽量当天完成测定。注意反复冻融会导致SOD部分失活。
2. 试剂盒的准备工作
① WST-8/酶工作液的配制
按照每个反应160 μL的体积配置适量的WST-8/酶工作液。均匀混合151 μL SOD检测缓冲液、8 μL WST-8和1 μL酶溶液,即可配置成160 μL WST-8/酶工作液。根据待检测样品(包括标准品)的数量,配置适量的WST-8/酶工作液。配制好的WST-8/酶工作液4℃或冰浴保存,可以在当天使用,但建议尽量现配现用。
【注】:由于酶溶液的用量较少且易沉降,必须注意在使用前先轻轻离心一下,然后适当混匀后再使用。
② 反应启动工作液的配制
把试剂盒中的反应启动液(40×) 融解后混匀,按照每1 μL反应启动液(40×)加入39 μL SOD检测缓冲液的比例进行稀释,混匀后即为反应启动工作液。根据待检测样品(包括标准品)的数量,配置适量的反应启动工作液。配制好的反应启动工作液4℃或冰浴保存, 可以在当天使用,但建议尽量现配现用。
③ (可选)SOD标准品准备
需自备SOD标准品,用本试剂盒提供的稀释液将SOD标准品稀释至以下系列浓度:200 U/mL,100 U/mL,50 U/mL,20 U/mL,10 U/mL,5 U/mL,2 U/mL。在随后的检测中可以各取20 µL,参考样品进行检测。
【注】:为避免稀释后SOD酶活性的下降, SOD标准品需现配现用;本试剂盒对于SOD的检测并不需要SOD作为标准品,但可以使用SOD标准品作为阳性对照或作为对SOD活性定量的参考。
3. 样品测定
① 参考下表使用96孔板设置样品孔和各种空白对照孔。并按下表依次加入待测样品和其它各种溶液。加入反应启动工作液后充分混匀。
【注】:加入反应启动工作液后反应即会开始,可以在低温操作或用排枪操作以减小各孔间因加入反应启动工作液的时间先后差异而导致的误差。
| 样品 | 空白对照1 | 空白对照2 | 空白对照3* | |
| 待测样品 | 20 µL | / | / | 20 µL |
| SOD检测缓冲液 | / | 20 µL | 40 µL | 20 µL |
| WST-8/酶工作液 | 160 µL | 160 µL | 160 µL | 160 µL |
| 反应启动工作液 | 20 µL | 20 µL | / | / |
【*】:如果样品有颜色或含有抗氧化物质,则需设置空白对照3;如果样品没有颜色并且也不含有抗氧化物则没有必要设置空白对照3。
② 37℃孵育30 min。【注】:孵育25-35 min检测出来的SOD活力无显著差异,但为保证检测结果的一致性,推荐孵育30 min。③ 在450 nm测定吸光度,如无450 nm滤光片,可以使用420-480 nm的滤光片。可以使用大于650 nm的波长作为参考波长进行双波长测定。
4. 样品中总SOD活力的计算
① 抑制百分率的计算
参考如下计算公式计算抑制百分率:
抑制百分率=[(A空白对照1-A空白对照2)-(A样品-A空白对照3)]/(A空白对照1-A空白对照2)×100%
如果没有设置空白对照3,则可以把计算公式简化为:
抑制百分率=(A空白对照1-A样品)/(A空白对照1-A空白对照2)×100%
【注】:尽量使样品的抑制百分率在30-70%范围内。如果计算出来的抑制百分率小于30%或大于70%,则通常需要把该样品重新测定。如果测定出来的抑制百分率偏高,则需适当稀释样品;如果测定出来的抑制百分率偏低,则需重新准备浓度较高的待测样品。
② SOD酶活力单位的定义:在上述黄嘌呤氧化酶藕联反应体系中抑制百分率为50%时,反应体系中的SOD酶活力定义为一个酶活力单位(unit)。
【注】:SOD活力单位的定义方式有很多种,不同的活力单位需根据其定义的不同进行适当换算。
③ SOD酶活力的计算
SOD酶活力的计算公式如下:
待测样品中SOD酶活力单位=检测体系中SOD酶活力单位=抑制百分率/(1-抑制百分率) units
例如,当抑制百分率为50%时,待测样品中SOD酶活力单位=50% / (1-50%)units=1 unit;当抑制百分率为60%时,待测样品中SOD酶活力单位=60% / (1-60%)units=1.5 units。
④ 如果样品为细胞或组织的匀浆液,可以根据样品的蛋白浓度和稀释倍数,将SOD活力单位换算为U/g或U/mg蛋白。如果样品为红细胞抽提液,可以根据血红蛋白含量,可换算为U/g血红蛋白或U/mg血红蛋白。
其他SOD检测参考方案
1:SOD酶活力计算的参考方案:可以先使用本试剂盒绘制SOD标准品的抑制百分率曲线,然后根据样品检测到的抑制百分率对比标准品的抑制百分率曲线计算出样品中的SOD酶活力单位。本方案仅供参考,使用本试剂盒时不必使用本方案进行检测和计算。
此外,本方案需确保标准品的酶活力数据可靠,不会因为标准品的保存问题而导致实际酶活力下降。
2:SOD酶活力的动力学检测:如果条件许可,使用本试剂盒时也可以使用动力学方法检测SOD的酶活力。通常在【步骤3 ① 后可以37℃孵育同时在560 nm连续测定吸光度30 min。根据30 min内的吸光度变化的斜率计算出抑制百分率:
抑制百分率=[(斜率空白对照1-斜率空白对照2)-(斜率样品-斜率空白对照3)]/(斜率空白对照1-斜率空白对照2)×100%
其余的计算方法同上述非动力学的计算方法。动力学方法的检测和计算更加精确一些,但检测起来相对要麻烦一些。
使用本试剂盒通常使用非动力学方法即可。
冰袋运输。-20℃保存,有效期6个月。【注】:WST-8溶液需避光保存。





