MolPure® DNAPurification Kit 采用 MolPure®DNAColumn P2 和新型的溶液体系,适用于去除 PCR 反应体系以及各种反应体系(如酶切体系,连接体系等)中的 dNTPs ,多余的引物,缓冲体系和酶等,也可用作 DNA 的浓缩和纯化。纯化过程中不需要用到有毒的酚氯仿等有机物抽提,也不需要用到耗时的异丙醇或乙醇沉淀。操作简便,10min 即可完成PCR 产物纯化,纯化后的DNA纯度高,可直接用于酶切、连接、转化、测序等后续实验。
应用:去除PCR反应体系以及各种反应体系(如酶切体系,连接体系等)中的dNTPs,多余的引物,缓冲体系和酶等,也可用作DNA的浓缩和纯化。
DNA回收片段范围 100p-40kb。
操作简便:15 min 即可完成纯化。
不能去除双链DNA模板以及>50 bp 的单链引物。
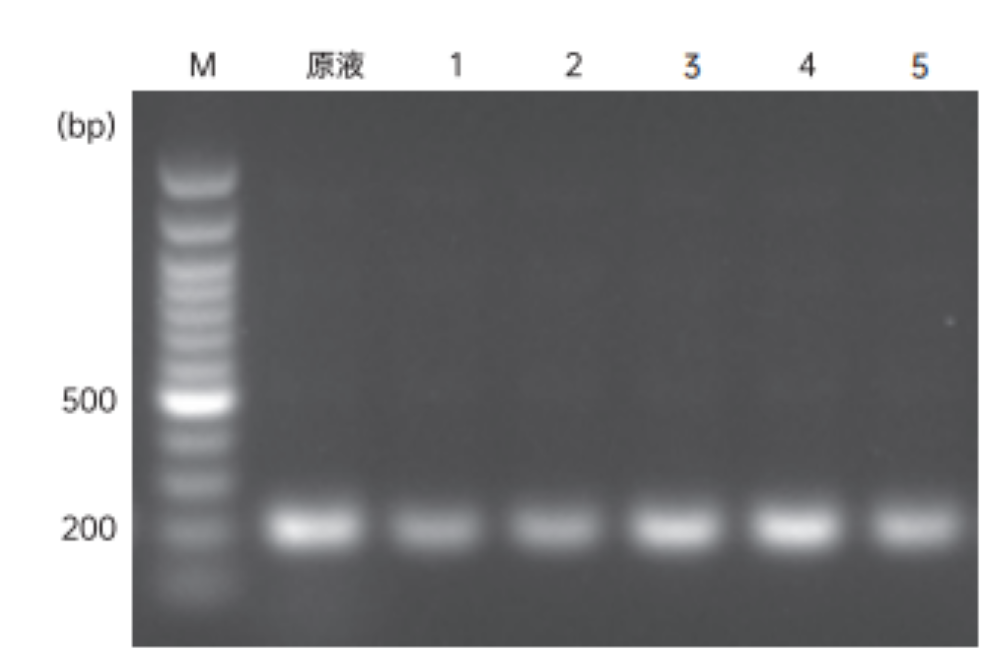
图1.琼脂糖电泳判定200 bp片段的回收产物量
(注:1.19001 M1907581,产物:溶胶液=1:1; 2.19001 M1907581,产物:溶胶液=1:4; 3.19001 M19024960,产物:溶胶液=1:1; 4. 19106; 5.T品牌)
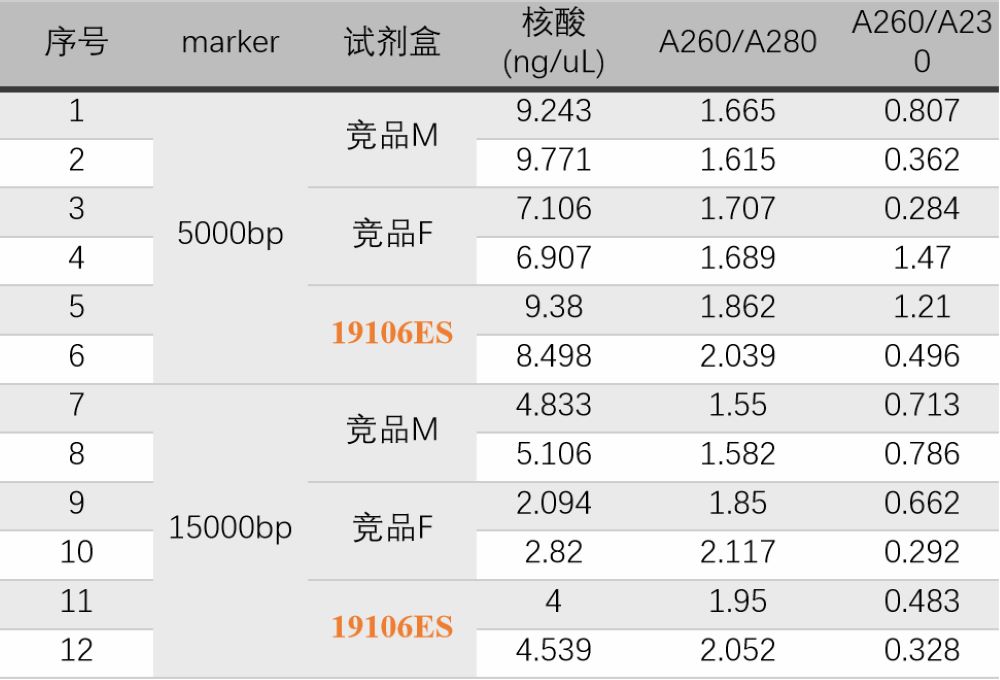
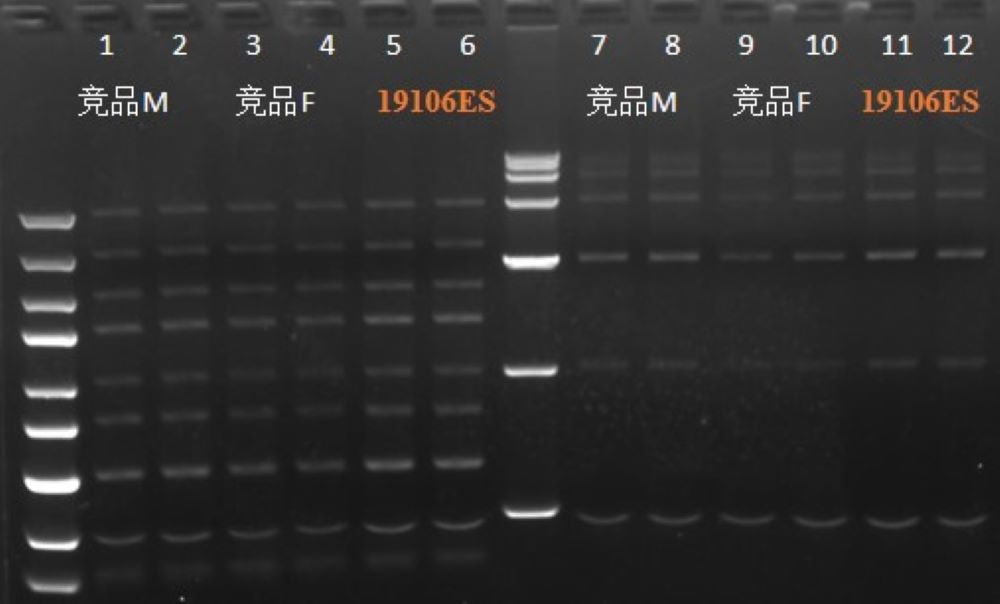
图2:取相同量的DNA marker进行DNA片段回收,提取得率19106≈竞品M>竞品F
室温避光保存,有效期2年。
[1] Wang H, Luo W, Wang X, et al. Testicular Nuclear Receptor 4 Regulates Proliferation and Apoptosis of Bladder Cancer via Bcl-2. Front Mol Biosci. 2021;8:670409. Published 2021 Sep 20. doi:10.3389/fmolb.2021.670409(IF:5.246)





