 趋化因子超家族-疾病新靶点
趋化因子超家族-疾病新靶点
人体在防御和清除入侵病原体等异物时,有一种使免疫细胞定向趋化的功能,此类引起这种功能的物质称之为趋化剂或趋化因子,具有重要的生理意义和病理作用,是当前热门研究的疾病新靶点。
一、趋化因子与受体
趋化因子是一类由细胞分泌的小细胞因子或信号蛋白,诱导临近反应细胞定向趋化的能力,命名为趋化细胞因子。在炎症、淋巴器官发育、细胞运输、淋巴组织内的滤泡形式、血管生成和伤口愈合中起重要作用。现有50多种趋化因子,之间有2个共同特征,首先分子量在8-10 kDa之间,另外具有四个位置保守的半胱氨酸残基以保证其三级结构。根据其主要蛋白质结构的前两个半胱氨酸“C”残基的位置,即结构分类,可分为C、CC、CXC和CX3C趋化因子四大类。
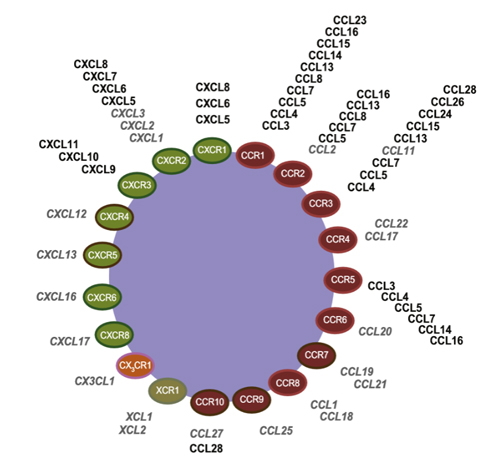
图1:趋化因子受体与配体
趋化因子受体是表达于免疫细胞、内皮细胞等细胞膜上介导趋化因子去行使功能的GTP-蛋白偶连的跨膜受体。分子约350个氨基酸,含一个短的酸性N端,7个螺旋跨膜结构域,3个胞内和3个胞外亲水环,以及一个胞内含有对受体调节重要的丝氨酸和苏氨酸残基的C端。其中1st -beta片层结构能够和血管内皮细胞上的氨基葡聚糖(GAG)结合,使其附着并富集于血管内皮细胞上。趋化因子受体胞外区的N端及一个以上的胞外环参与其配体的结合,且N端的序列在很大程度上决定了受体对趋化因子的特异性选择。
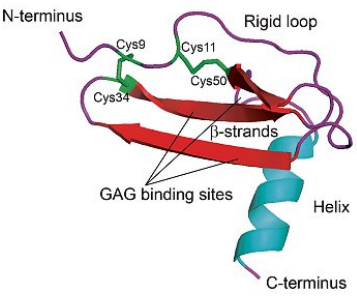
图2:趋化因子受体的折叠与构造
趋化因子与其受体有交叉作用,一个趋化因子可与多个趋化因子受体结合,一个受体也可以有多个高亲和的趋化因子配体。趋化因子与其受体的相互作用调控免疫细胞在循环系统和组织器官间定向迁移,使免疫细胞到达感染、创伤和异常增殖部位,执行清除感染源、促进创伤愈合和消灭异常增殖细胞、维持组织细胞平衡的功能。
表1:人属源趋化因子与受体名录
|
家族分类 |
趋化因子 |
别名 |
受体 |
作用细胞 |
|
C |
XCL1 |
ATAC,Lymphotactin,CSM-1a |
XCR1 |
T |
|
XCL2 |
SCM-1β |
XCR1 |
T |
|
|
CC |
I-309,TCA-3,P500 |
CCR8 |
单核 |
|
|
MCP-1,MCAF |
CCR2 |
T,NK,DC,单核,嗜碱 |
||
|
MIP-1a,LD78a |
CCR1,CCR5 |
T,NK,DC,单核,嗜酸 |
||
|
CCL4 |
MIP-1β |
CCR5 |
T,NK,DC,单核 |
|
|
CCL5 |
RANTES |
CCR1,CCR3,CCR5 |
T,NK,DC,单核,嗜碱,嗜酸 |
|
|
CCL6 |
C10,MRP-1 |
CCR1 |
T,单核,巨噬,嗜酸 |
|
|
CCL7 |
MCP-3 |
CCR1,CCR2,CCR3 |
T,NK,DC,单核,嗜酸,嗜碱 |
|
|
CCL8 |
MCP-2 |
CCR3 |
T,NK,DC,单核,嗜碱 |
|
|
CCL9/CCL10 |
MRP-2,CCF18,MIP-1γ |
CCR1 |
T,单核 |
|
|
CCL11 |
Eotaxin-1 |
CCR3 |
T,DC,嗜酸,嗜碱 |
|
|
CCL12 |
MCP-5 |
CCR2 |
T,NK,DC,单核,嗜碱 |
|
|
CCL13 |
MCP-4 |
CCR2,CCR3 |
T,NK,DC,单核,嗜酸,嗜碱 |
|
|
CCL14 |
HCC-1,HCC-3 |
CCR1 |
T,单核,嗜酸 |
|
|
CCL15 |
HCC-2,Leukotactin-1,MIP-1δ |
CCR1,CCR3 |
T |
|
|
CCL16 |
HCC-4,LEC,LCC-1 |
CCR1 |
T |
|
|
TARC |
CCR4 |
T,DC,单核 |
||
|
CCL18 |
DCCK1,PARC,AMAC-1 |
? |
T,DC |
|
|
CCL19 |
MIP-3β,ELC,Exodus-3 |
CCR7 |
T,B,DC |
|
|
MIP-3α,LARC,Exodus-1 |
CCR6 |
DC |
||
|
6Ckine,SLC,Exodus-2,TCA-4 |
CCR7 |
T,DC |
||
|
CCL22 |
MDC,STCP-1,ABCD-1 |
CCR4 |
T,DC,单核 |
|
|
CCL23 |
MPIF-1 |
CCR1 |
T |
|
|
CCL24 |
MPIF-2,Eotaxin-2 |
CCR3 |
T,DC,嗜酸,嗜碱 |
|
|
CCL25 |
TECK |
CCR9 |
T,DC,单核 |
|
|
SCYA26,Eotaxin-3 |
CCR3 |
T |
||
|
CTACK,ALP,ESkine |
CCR10 |
T |
||
|
MEC |
CCR3,CCR10 |
T,B,嗜酸, |
||
|
CXC |
GROa,MGSAa |
CXCR1,CXCR2 |
中性粒细胞 |
|
|
GROβ,MGSAβ |
CXCR2 |
中性粒细胞 |
||
|
GROγ,MGSAγ |
CXCR2 |
中性粒细胞 |
||
|
PF4 |
CXCR3-B |
嗜酸,嗜碱,T |
||
|
ENA-78 |
CXCR2 |
中性粒细胞 |
||
|
GCP-2,CKa-3 |
CXCR1,CXCR2 |
中性粒细胞 |
||
|
NAP-2 |
CXCR2 |
中性粒细胞 |
||
|
IL-8 |
CXCR1,CXCR2 |
中性粒细胞 |
||
|
Mig |
CXCR3-A,CXCR3-B |
T,NK |
||
|
IP-20 |
CXCR3-A,CXCR3-B |
T,NK |
||
|
I-TAC |
CXCR3-A,CXCR3-B |
T,NK |
||
|
SDF-1a/β |
CXCR4 |
T,B,DC,单核 |
||
|
BLC,BCA-1 |
CXCR5 |
B |
||
|
CXCL14 |
BRAC,Bolekine |
? |
DC,单核 |
|
|
CXCL15 |
Lungkine |
? |
中性粒细胞 |
|
|
CXCL16 |
SR-PSOX |
CXCR6 |
T,NKT |
|
|
DMC |
CXCR8 |
DC,单核 |
||
|
CX3C |
CX3CL1 |
Fractalkine,Neurotactin |
CX3CR1 |
T,NK,单核 |
二、趋化因子的功能
趋化因子可诱导控制细胞定向迁移,被趋化因子吸引的细胞沿着趋化因子浓度增加的信号向趋化因子源处的迁徙。其基本功能如下:
1. 趋化作用,如T辅助细胞(TH22)表达趋化因子受体CCR6,并向肿瘤微环境中存在的配体CCL20迁移;
2. 活化白细胞,如在炎症部位形成浓度梯度,富集活性强的白细胞;
3. 血管生成,如ELRCXC,CCL2促进血管生成,CXCL10,CCL21/SLC抑制血管生成;
4. 促进细胞脱颗粒和生物活性物质释放,如CCL2介导Bas释放组织胺,CXCL8介导Neu生成活性物质和呼吸爆发;
5. 调控免疫细胞分化,发育,成熟,归巢,相互作用等。
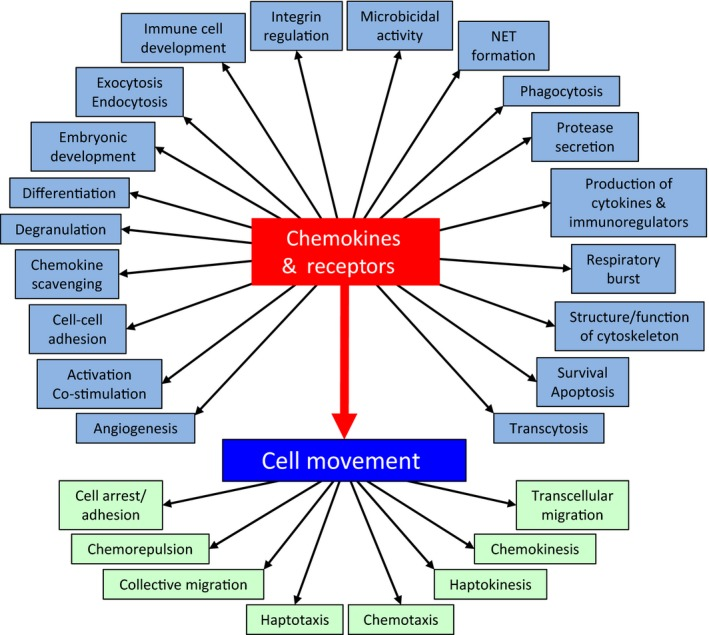
图3:趋化因子及受体功能与细胞学功能
三、趋化因子的信号传导
趋化因子受体激活G蛋白后传递细胞信号,随后磷脂酶C (PLC)被激活。PLC将磷脂酰肌醇(4,5)-二磷酸(PIP2)催化生成两个第二信使分子,分别为肌醇三磷酸(IP3)和甘油二酯(DAG),放大细胞内信号传递;DAG激活蛋白激酶C(PKC),IP3触发细胞内钙的释放。二者信号的激活促进许多信号级联反应(比如MAP激酶途径),产生如趋化、脱颗粒、超氧阴离子释放以及细胞整合素的变化。趋化因子通过这种机制来诱导响应细胞定向趋化。
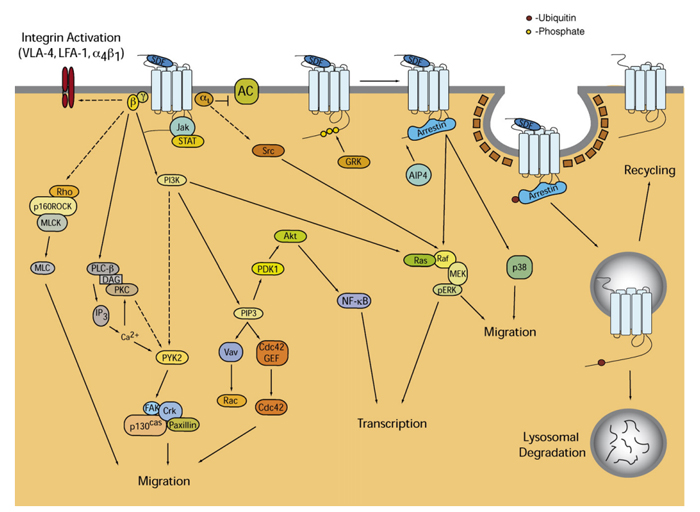
图4:趋化因子与受体的信号传导与调控示意图
四、趋化因子超家族与疾病新靶点
趋化因子及其受体的发现是人类征服疾病过程中的重要里程碑,并诞生一门新学科——趋化因子学(chemokinology)。目前该领域的多学科研究已经揭开不少趋化因子及其受体的秘密,因此趋化因子及其众多受体也成为潜在药物的新靶点。其中重要的研发领域可以简单划分为三个方向:HIV,肿瘤,慢性炎性疾病。
1.HIV中明确辅助受体靶点为CCR5和CXCR4。2007年辉瑞的Maraviroc针对CCR5靶点,另健赞的Plerixafor针对CXCR4靶点,此外有4项已处于临床研发阶段的药物。
2.NOXXON Pharma开发的NOX-A12是一款靶向基质细胞衍生因子-1(SDF-1,又称趋化因子CXCL12)的聚乙二醇化的核酸适配体药物,在血管生成,防治肿瘤组织的“修复”和抗癌免疫细胞(如杀伤性T细胞)进入肿瘤中发挥巨大作用。
3.炎症相关的哮喘、类风湿性关节炎、炎性肠病各有一项临床在研药物,分别是AXP1275,CCX354和CCX507。
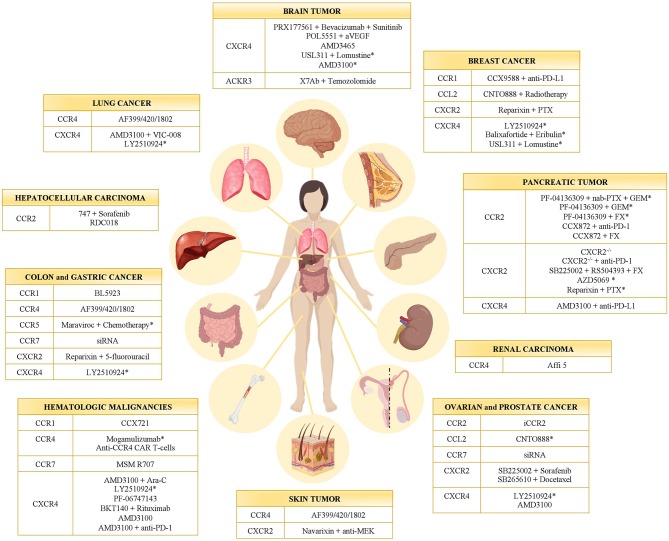
图5:癌症中趋化因子受体抑制剂示意图
YEASEN高活性的趋化因子超家族细胞因子适用于炎症,肿瘤研究等领域,以期助力研究工作对机制研究和潜在临床价值的探索。产品在上市前均严格质检,以确保生物活性和批次间的一致性。
相关产品
参考文献
1. Thelen, Marcus. Encyclopedia of Immunobiology || Function of Chemokines and Their Receptors in Immunity[J]. 2016:572-578.
2. Legler D F , Thelen M . Chemokines: Chemistry, Biochemistry and Biological Function[J]. Chimia, 2016, 70(12):856-859.
3. Roitt's Essential Immunlogy第13版,p231.
4. Hughes C E , Nibbs R . A guide to chemokines and their receptors[J]. Febs Journal, 2018, 285(16).
5. Busillo J M , Benovic J L . Regulation of CXCR4 signaling[J]. Biochimica Et Biophysica Acta Biomembranes, 2007, 1768(4):952-963.
6. Tanaka T , Bai Z , Srinoulprasert Y , et al. Chemokines in tumor progression and metastasis[J]. Cancer Science, 2005, 96(6):317-322.
7. Poeta V M , Massara M , Capucetti A , et al. Chemokines and Chemokine Receptors: New Targets for Cancer Immunotherapy[J]. other, 2019, 10.


