Hieff NGS® Hyb & Wash Kit with Universal Blocking Oligo for Illumina
Illumina平台捕获杂交清洗试剂盒
产品介绍
Hieff NGS® Hyb & Wash Kit with Universal Blocking Oligo for Illumina是专门针对翌圣靶向捕获系列产品开发的捕获杂交清洗试剂,搭配新型双链DNA探针(100-mer)将目标DNA捕捉并富集后进行高通量测序,精心优化的一管式杂交缓冲液体系能得到更稳定且更优异的捕获效果。NGS靶向捕获试剂盒凭借卓越的产品性能,更好的灵敏度及特异性,广泛应用于新型分子诊断与检测等领域的研究。试剂盒中提供的所有试剂都经过了严格的质量控制和功能验证,最大程度上保证了实验的稳定性和重复性。
产品特色
1、兼容性好:可适配DNA捕获探针和RNA捕获探针;
2、适用性广:可应用于肿瘤伴随诊断、用药评估、遗传筛查、分子育种、等多个应用方向。
3、操作简便:仅需单管操作,操作步骤简单,兼容性好。
4、对设备依从性低:可用磁珠浓缩替代真空浓缩仪。
应用案例
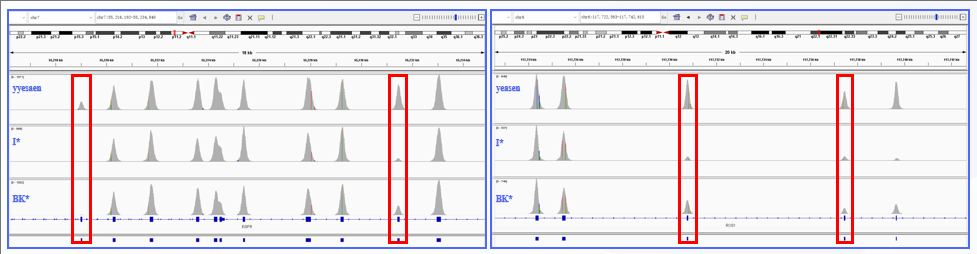
一、Hieff NGS® Hyb & Wash Kit 可适配其他厂家 探针,数据更均一。
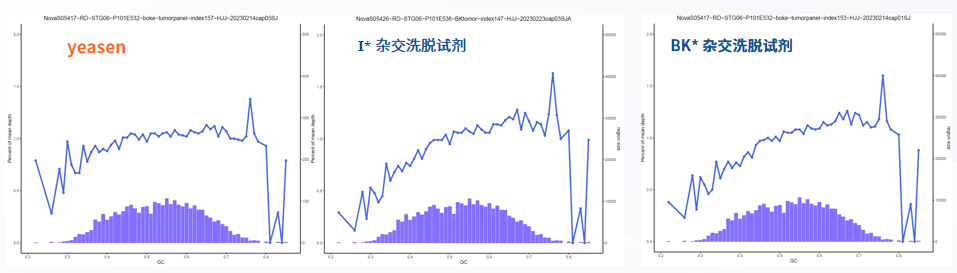
Hieff NGS® Hyb & Wash Kit 杂交洗脱体系搭配竞品 3 Tumor Panel 的均一性表现。按照厂家提供的操作说明书进行,NovaSeq 6000平台PE150 测序,柱状图是目标区域里不同GC含量的区域大小,曲线是不同 GC 含量区域的覆盖深度。
存储条件
BOX-I:-25~-15℃保存,有效期1年。
BOX-II:室温保存,有效期1年。
BOX-III:-25~-15℃保存,有效期1年。
COA





