 浅谈翌圣生物对生物制品的质控策略
浅谈翌圣生物对生物制品的质控策略
根据《中国药典》,生物制品是指以微生物、细胞、动物或人源组织和体液等为原料,应用传统技术或现代生物技术制成,用于人类疾病的预防、治疗和诊断的药品。其中,人用生物制品包括细菌类疫苗、病毒类疫苗、抗毒素和抗血清、血液制品、细胞因子、生长因子、酶、体内及体外诊断制品以及其他生物活性制剂等。
生物制品因具有更强的特异性、能与分子靶点结合、疗效好、副作用少等特点,获得快速发展。然而生物制品成分多样,结构复杂,生产工艺也各不相同,在制备过程中较容易受到污染和产生杂质。
常见的污染物是指带入的外源性物质,如生物性原材料携带的病原微生物(eg.细菌、支原体、分枝杆菌、内源性病毒和外界污染的病毒)。杂质一般分为产品相关杂质和工艺相关杂质。产品相关杂质包括聚体、降解产物、电荷异构体、疏水变体、无活性的病毒颗粒、非目的范围的多糖、包装不完整的病毒样颗粒等。工艺相关杂质包括细胞基质(宿主细胞蛋白、宿主细胞DNA)、细胞培养物(诱导剂、抗生素或培养基成分)或下游工艺残留物。这些杂质和污染物等不仅会影响生物药的药效,还可能存在安全性隐患,因此药物的研发和生产过程需要进行严格的质量管控。
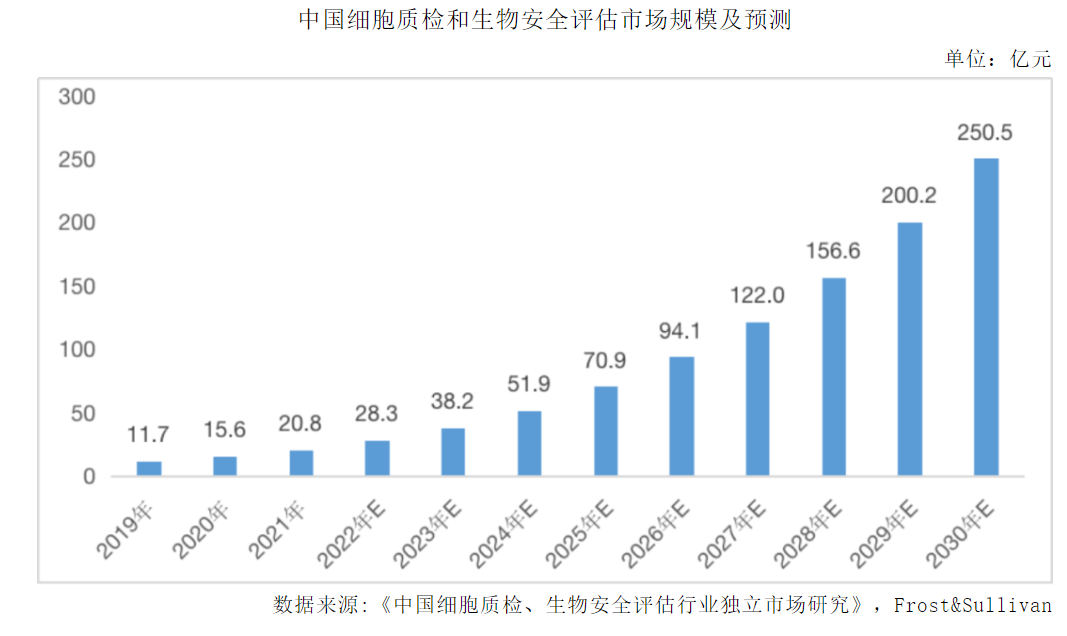
随着国内生物制药行业的高速发展,质控市场也迎来了快速增长。一方面药物的不断创新对生物安全质控检测的需求不断提升:从早期的化药、重组蛋白药、传统疫苗等到后来的抗体药、基因细胞治疗药物、mRNA疫苗、小核酸药物、干细胞产品等药物的创新性带来了对生物安全检测的复杂性要求。另一方面,生物医药行业发展也对质控提出了高的要求:生物药市场规模的增长和研发投入的增加,推动研发过程安全质检的需求提升;创新药企创始人从海外归国,对质控安全的重视和要求提升,中美、中欧双报等创新药管线的增加对安全质控要求与国际接轨;新兴治疗技术的涌现,如基因治疗、细胞治疗和核酸药物研发等新兴疗法和技术对质控安全提出全新的要求。
虽然质控市场规模在增长,但生物制品的质控检测领域目前还较少被资本市场关注,因此相关的行业研报比较有限,下述是目前查阅到的质控相关国内市场规模情况:
生物制品的生产工艺中涉及的杂质残留和污染物,对最终成品的安全性和有效性影响重大,受到各国药监部门严格监管。因此,翌圣生物自主研发了一系列生物制品质量安全控制产品,用于检测宿主细胞DNA残留、核酸酶残留、复制型慢病毒、病毒载体拷贝数和支原体污染等。
大多数应用于细胞基因治疗的逆转录病毒和慢病毒均被设计为复制缺陷型病毒载体。对于复制缺陷型病毒载体,在生产中可能发生经缺失改造的载体与野生型病毒序列之间的同源重组,导致产生复制型病毒,因此应进行RCL的检测。
翌圣生物自主研发了复制型慢病毒(RCL)检测试剂盒,采用qPCR法特异性扩增慢病毒的包膜质粒VSV-G序列,专一快速的检测各种使用慢病毒载体相关的细胞产品中可能发生的复制型慢病毒的潜在风险。检测样本类型包含:生产过程中的病毒(上清液、病毒生产终末期细胞)、放行检验中的细胞终产品。
含CAR或TCRαβ序列的目的基因构建到慢病毒或逆转录病毒载体中,再将载体基因整合到T细胞基因组中,一方面显示有T细胞进行了CAR或TCR基因修饰,一方面又是一个安全性指标,可能会因整合而带来原癌基因激活或抑癌基因失活等造成二次肿瘤的风险。因此,需进行CAR和TCR拷贝数检测。
翌圣生物自主研发了CAR/TCR基因拷贝数检测试剂盒,采用多重荧光探针qPCR法分别检测CAR-T或TCR-T细胞基因组中CAR或TCR基因的拷贝数以及人体细胞中单拷贝基因(SCG),用以监测转基因整合的风险。检测样本类型包含:CAR-T或TCR-T细胞悬液收获阶段和接受CAR-T或TCR-T细胞治疗的患者定期取外周血随访监测阶段。
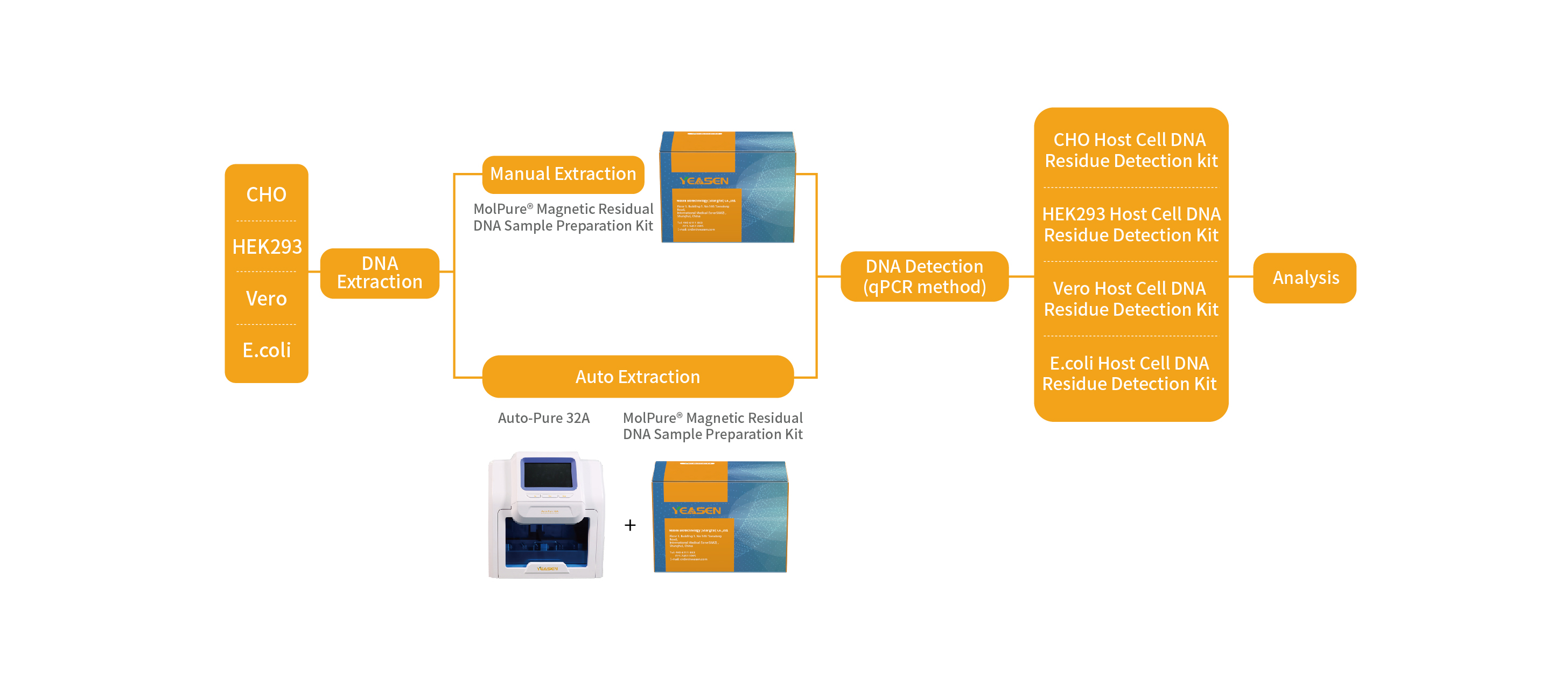
去除宿主细胞杂质是生物制药产品生产中的关键步骤,其中宿主细胞残留DNA由于可能存在的免疫原性、感染性以及致瘤性等安全问题成为关键质控指标。药监局规定,细胞表达产物的最终产品中DNA含量应尽可能低,必须采用高灵敏度的方法进行定量。翌圣生物自主研发的E.coli&HEK293&CHO&Vero共4款宿主细胞残留DNA的qPCR法检测试剂盒,可快速高效检测生物药中宿主DNA残留量。
在生物制品的生产工艺中,去除细胞中的杂质是纯化工艺中至关重要的一步,全能核酸酶能够高效去除生物制品中的核酸残留。全能核酸酶残留量是生物制品杂质分析中的重要检测项,翌圣生物提供能准确检测全能核酸酶残留量的ELISA Kit。
支原体污染不仅会导致生物制品品质下降,还会降低其表达水平,最终导致产量降低,同时也会对患者产生不良的副作用。目前国内外药典推荐的支原体检测方法主要是基于培养法、NAT(核酸扩增法)法、细胞培养指示法。
翌圣生物经过匠心研发,基于EP药典推荐NAT法推出超简便快捷的qPCR支原体检测试剂盒,克服了普通PCR灵敏度低和培养法耗时久的问题,提升了结果精准度和使用便捷度。
以双向分子酶设计与定向进化平台和蛋白高密度发酵与超洁净纯化平台为依托,建立分子诊断试剂关键原料研发平台和独立的分子和免疫检测产品开发实验室,并配备了先进的研发仪器设备。
严格按照ISO13485质量体系标准建设和管理,拥有独立的洁净生产车间,满足不同产品定量和定性的要求。层层把关,每一步的放行,都经过多项严格而高标准的质量验收。
 浅谈翌圣生物对生物制品的质控策略
浅谈翌圣生物对生物制品的质控策略

 浅谈翌圣生物对生物制品的质控策略
浅谈翌圣生物对生物制品的质控策略


