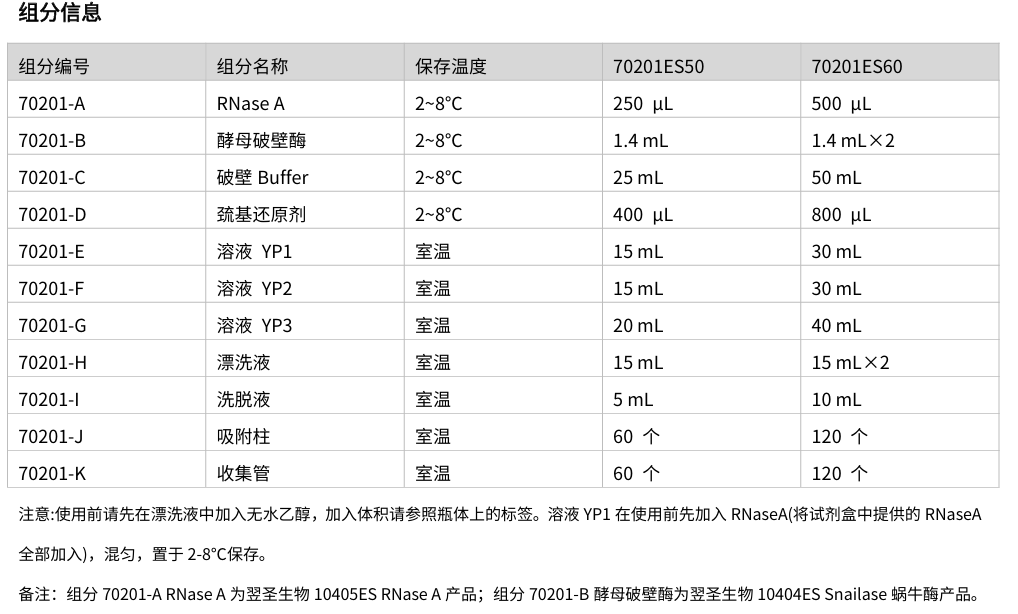
试剂盒采用酶法破碎酵母细胞壁来提取酵母质粒DNA。所采用的酵母破壁酶能有效地破坏酵母细胞壁,提高酵母质粒DNA的产量。吸附柱中采用的硅基质材料能高效、专一地吸附DNA,可最大限度去除杂质蛋白质及细胞中其他有机化合物。使用本试剂盒提取的酵母质粒DNA可适用于各种常规的分子生物学实验,包括酶切、PCR、测序、连接和转化等试验。本试剂盒无需使用酚、氯仿等有毒试剂,操作安全。
操作步骤
1. 取1-5mL酵母培养物(不超过5×107cells),12000rpm离心1min, 尽量吸除上清(菌液较多时可以通过多次离心将菌体
沉淀收集到一个离心管中)。
2. 酵母细胞壁的破除: 向酵母菌体中加入470 μL破壁Buffer, 充分悬浮菌体, 加入25 μL酵母破壁酶和5 μL巯基还原剂,
充分混匀,37 ℃处理1-2h, 期间可颠倒离心管混匀数次。12000rpm离心1min,弃上清, 收集沉淀。
3. 向沉淀中加入250 μL溶液YP1(请先检查是否已加入RNaseA), 充分悬浮沉淀。
注意:如果菌块未彻底混匀,会影响裂解导致质粒提取量和纯度偏低。
4. 向离心管中加入250 μL溶液YP2, 温和地上下翻转 6-8次使菌体充分裂解。
注意:混匀一定要温和, 以免污染细菌基因组DNA, 此时菌液应变得清亮粘稠, 作用时间不要超过5min, 以免质粒受
到破坏。
5. 向离心管中加入350 μL溶液YP3, 立即温和地上下翻转6-8次, 充分混匀, 此时会出现白色絮状沉淀。12000rpm离心
10min, 用移液器小心地将上清转移到另一个干净的离心管中, 尽量不要吸出沉淀。
注意: 溶液YP3加入后应立即混合避免产生局部沉淀。如上清中还有微小白色沉淀, 可再次离心后取上清。
6. 将上一步所得上清液加入吸附柱中, 室温放置2min,12000rpm离心1min, 倒掉收集管中的废液, 将吸附柱重新放回
收集管中。
7. 向吸附柱中加入600 μL漂洗液(使用前请先检查是否已加入无水乙醇),12000rpm离心1min, 弃废液, 将吸附柱放入收
集管中。
8. 向吸附柱中加入600 μL漂洗液,12000rpm离心1min, 弃废液, 将吸附柱放入收集管中。
9. 12000rpm离心2min, 将吸附柱敞口置于室温或50 ℃温箱放置数分钟, 目的是将吸附柱中残余的漂洗液去除, 否则
漂洗液中的乙醇会影响后续的实验如酶切、PCR等。
10. 将吸附柱放入一个干净的离心管中, 向吸附膜中央悬空滴加30-50 μL经65 ℃水浴预热的洗脱液, 室温放置2min,
12000rpm 离心1min。
11. 为了增加质粒的回收效率, 可将得到的洗脱液重新加入吸附柱中, 室温放置2min,12000rpm离心1min。
注意事项
1. 使用前请先检查溶液YP2和溶液YP3是否出现混浊, 如有混浊现象, 可在37 ℃水浴中加热几分钟, 待溶液恢复澄清后再
使用。
2. 洗脱缓冲液体积不应少于50 μL, 体积过小影响回收效率; 洗脱液的pH值对洗脱效率也有影响, 若需要用水做洗脱液应
保证其pH值在8.0左右(可用NaOH将水的pH值调至此范围),pH值低于7.0 会降低洗脱效率;DNA产物应保存在-25~-15 ℃, 以防DNA降解。
3. 质粒得率与酵母菌株、质粒拷贝数、培养条件等因素有关。通常酵母质粒拷贝数都很低, 一般通过电泳或分光光度计法
都很难检测到, 可通过PCR或转化大肠杆菌来检测。
4. DNA浓度及纯度检测: 得到的基因组DNA片段的大小与样品保存时间、操作过程中的剪切力等因素有关。回收得到的
DNA片段可用琼脂糖凝胶电泳和紫外分光光度计检测浓度与纯度。DNA应在OD260处有显著吸收峰,OD260值为1相当于
大约50 μg/mL双链DNA、40 μg/mL单链DNA。OD260/OD280比值应为1.7-1.9, 如果洗脱时不使用洗脱缓冲液, 而使
用去离子水, 比值会偏低, 因为pH值和离子存在会影响光吸收值, 但并不表示纯度低。
2~8 ℃干燥保存, 有效期2年。





