2019年国家药监局发布的《医疗器械注册工作》中医疗器械注册申请共计5877项,体外诊断试剂注册申请共计3227项。而2018年的体外诊断注册申请仅817项,特别地在今年对于体外诊断的需求也刺激了体外诊断市场不断扩张。
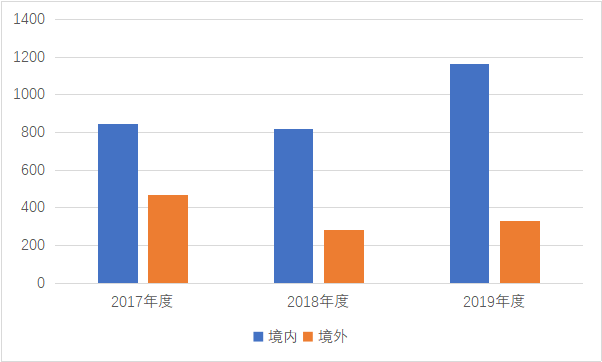
图1. 2017年至2019年体外诊断试剂注册项目回顾
体外诊断试剂产品的注册过程中要求提供申报产品的分析性能评估资料,产品性能评估是产品研发、制定产品标准等过程的重要技术支持研究过程,并可能对产品的质量造成一定的影响。面对不断增加的体外诊断试剂的需求,如何对有效对诊断试剂进行系统的评估尤为重要。
目前国际上对体外诊断试剂的性能评估通常是以美国临床实验室标准化组织(Clinical and Laboratory Standards Institude以下称为CLSI)的相关标准为依据,也是美国FDA推荐采用的评价标准,但我国还没有相关的标准及指导原则的要求。在国家药监局发布的《诊断试剂体外诊断试剂分析性能评估体系指导原则(征求意见稿)》中提出了为进一步明确体外诊断试剂分析性能评估的技术要求,以明确体外诊断试剂产品性能评估的技术要求。体外诊断试剂产品性能评估包括检测限、线性范围、可报告范围、准确度(回收实验)、准确度(方法学比较)、精密度、干扰实验、稳定性、参考区间共九个项目。
检测限(limit of detection)是指检测方法可检测出的最低被测量浓度,也称检测低限(lower limit of detection)或最小检出浓度(minimum detectable concentration),有时也称为分析灵敏度(analytical sensitivity)
精密度是衡量体外诊断试剂批内和批间变异的重要指标,通常包括批内和批间不精密度。
干扰物质是体外诊断试剂使用过程中造成测量误差的一个主要原因,针对体外诊断试剂进行的干扰实验是指通过实验查找出对体外诊断试剂测量结果产生影响的物质的过程。干扰实验评估资料是评价拟上市产品有效性的重要依据,也是产品注册所需的重要申报资料之一。
稳定性评估资料是评价拟上市产品有效性的重要依据,其中包括对于储存稳定性、开瓶稳定性、运输稳定性进行探讨。
Hieff® Direct Taq DNA Polymerase(5U/μL)(Cat:10709ES)
高纯度:纯度>95%,无核酸酶残留,宿主gDNA残留量低
良好的批次稳定性:严苛的生产流程和质检标准,保证不用批次产品性能稳定性
稳定的生产产能:大规模生产体系,单批次产能达g级;稳定供应,货期短
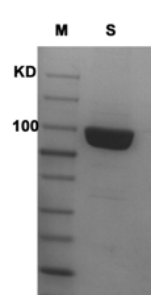
图2. 上样量1-5 μL,经SDS-PAGE电泳,考马斯亮蓝染色,Hieff® Direct Taq DNA Polymerase 纯度大于95%。
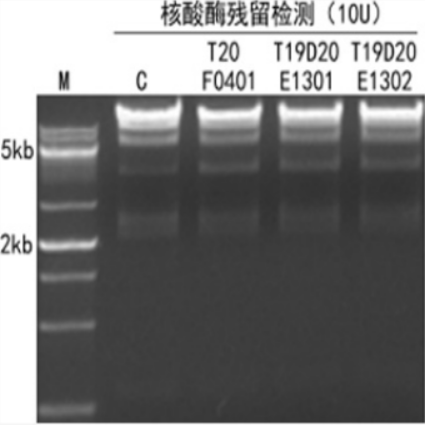
图3. 50 μL反应体系中,加入10U Hieff® Direct Taq DNA Polymerase,与500 ng λ DNA/Hind III酶切产物,在37℃孵育4h,酶切产物带型无变化,无核酸酶残留。
图4. 10μl反应体系,取10U非热启动Taq酶,与500ng IL23R 超螺旋质粒在37℃孵育4h;电泳观察带型变化。结果显示无切口酶残留,表明本品无切口酶残留。
表1. 磷酸酶活性(pNPP,缓冲液)-200 μL的反应缓冲液含1 M二乙醇胺 、0.5 mM MgC12、2.5 mM对硝基苯磷酸盐(pNPP)以及至少40 μL标准Taq(不含Mg2+);通过分光光度法测定并且在37 ℃下4小时可产生<0.0001单位的碱性磷酸酶活性。10U三批次D-Taq酶磷酸酶残留均小于0.0001U。
|
酶
|
用量
|
37度反应起点OD405
|
37度4小时终点OD405
|
|
磷酸酶
|
0.001U
|
0.167
|
2.798
|
|
磷酸酶
|
0.0001U
|
0.132
|
1.111
|
|
磷酸酶
|
0.00001U
|
0.13
|
0.246
|
|
磷酸酶
|
0.000001U
|
0.134
|
0.158
|
|
磷酸酶
|
0.0000001U
|
0.126
|
0.142
|
|
T19D20C0401
|
10U
|
0.117
|
0.123
|
|
T19D20E1301
|
10U
|
0.13
|
0.138
|
|
T19D20G0301
|
10U
|
0.13
|
0.136
|
|
Taq buffer
|
2ul
|
0.128
|
0.135
|
|
blank
|
|
0.114
|
0.129
|
表2. 将待检酶94℃加热30min、60min之后测定酶活。94℃加热1小时仍具有不低于50%的酶活。
| |
94℃
|
|
加热时间
|
0min
|
30min
|
60min
|
|
酶活
|
100%
|
87%
|
50.60%
|
图6. 50 μL体系中,加入2U的酶,以无菌ddH2O为模板,扩增E.coil 16s rDNA基因。35个循环后扩增产物进行1% 琼脂糖凝胶电泳,EB染色。无扩增条带。
Uracil DNA Glycosylase (UDG/UNG), heat-labile(Cat:10303ES)
10U热敏UDG中大肠杆菌基因组残留低于10拷贝
无核酸酶残留
尿嘧啶是此酶识别的唯一碱基
图7. 上样量为5-20 μL,经SDS-PAGE电泳,考马斯亮蓝染色,纯度大于95%。
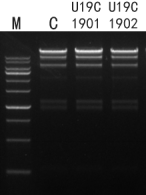
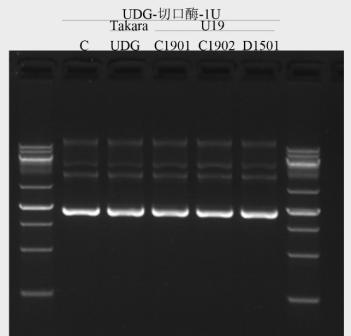
图8. 在50μL反应体系,取1U酶,与500ng lambda DNA/Hind III酶切产物在37℃孵育4h;电泳观察带型变化。结果显示带型及条带深浅与对照一致,无核酸酶残留。
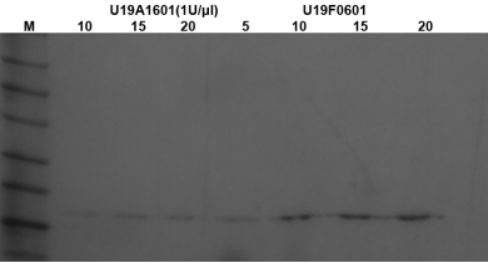
图9. 在10μL反应体系,取1U酶,与500ng IL23R 超螺旋质粒在37℃孵育4h;电泳观察带型变化。结果显示,带型及条带深浅与对照一致,无切口酶残留。
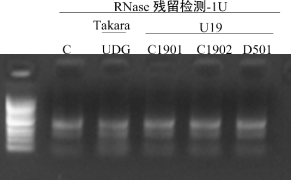
图10. 10μl反应体系,取1U酶,与500 ng 293T RNA 在37℃孵育4h;电泳观察带型变化,与阴性带型一致-合格。
Hifair® V Reverse Transcriptase (Cat:11300ES)
Hifair® V Reverse Transcriptase 是在 Hieff® M-MLV (H-) Reverse Transcriptase 基础上通过基因工程技术得到的逆转录酶,与 Hieff® M-MLV (H-) Reverse Transcriptase 相比,其热稳定性大幅度提高,可耐受高达 60℃的反应温度,适合具有复杂二级结构的 RNA 模板的逆转录。同时,该酶增强了与模板的亲和力,适合少量模板以及低拷贝基因的逆转录。Hifair® VReverse Transcriptase 合成全长 cDNA 的能力也有了提升,可扩增长达 10 kb 的 cDNA。
产品特点
兼容性:适合不同GC含量、不同表达丰度基因逆转录
灵敏度高
图11. 上样量2 μg,经SDS-PAGE电泳,考马斯亮蓝染色,根据条带分析纯度。纯度大于95%。
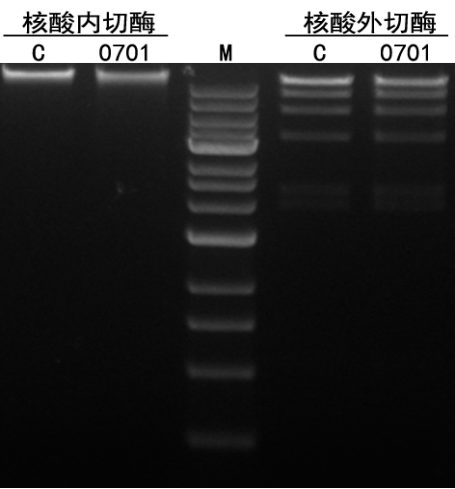
图12.在200 U本酶和1 μg Supercoiled pBR322 DNA,37℃下孵育1 h,结果显示无核酸内切酶残留。在200 U本酶和1 μg λDNA-Hind Ⅲ,37℃下孵育1 h,结果显示DNA的电泳谱带不发生变化,无核酸外切酶残留。
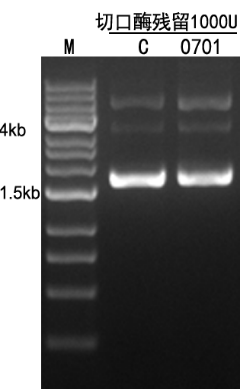
图13. 在10μl反应体系,取1000U 反转录酶,与500ng IL23R 超螺旋质粒在37℃孵育4h。结果显示电泳观察带型,无变化无切口酶残留。
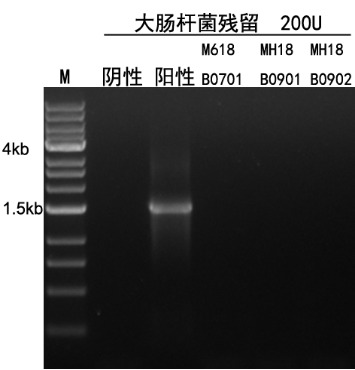
图14. 在50 μL体系中,加入200U的酶,以无菌ddH2O为模板,扩增E.coil 16s rDNA基因。35个循环后扩增产物进行1% 琼脂糖凝胶电泳,EB染色。结果显示无扩增条带即无大肠杆菌基因组残留。
更多翌圣体外诊断原料:
HB210113
 透过《体外诊断试剂分析性能评估体系指导原则》看IVD原料的核心品质
透过《体外诊断试剂分析性能评估体系指导原则》看IVD原料的核心品质