 干货分享|如何破解生物制品中的核酸残留难题?
干货分享|如何破解生物制品中的核酸残留难题?

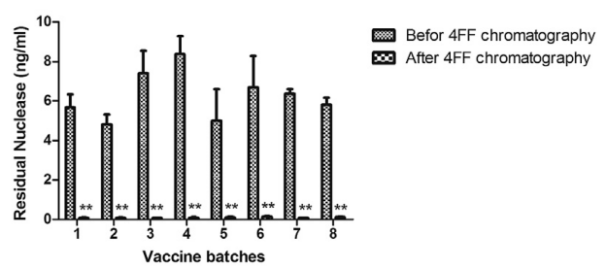
图2. 经过核酸酶处理的样品,残留量降至100pg/mL以下
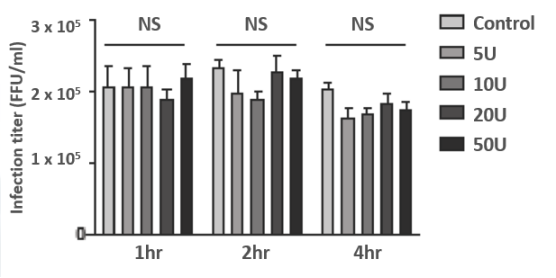
图3. 核酸酶的处理对病毒感染效率无显著影响
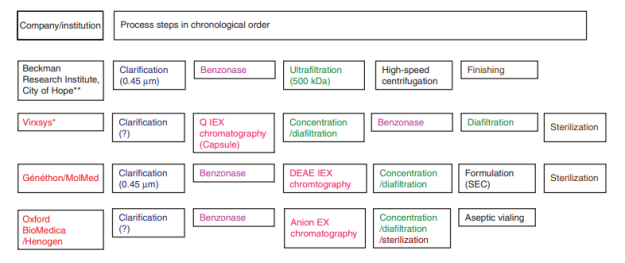
图4. 不同公司/研究所采用的慢病毒大规模纯化步骤中均含有全能核酸酶处理步骤【5】
|
货号 |
20125ES |
||
|
级别 |
科研级别 |
科研级别/无内毒素 |
GMP级 |
|
宿主来源 |
大肠杆菌 |
酵母 |
大肠杆菌 |
|
动物源性 |
有 |
- |
无 |
|
抗生素 |
有 |
无 |
无 |
|
IPTG残留验证 |
- |
- |
√ |
|
生产管理标准 |
- |
- |
ISO9001/GMP |
|
外观(无色) |
√ |
√ |
√ |
|
比活 |
≥2×10⁴U/mg |
≥1×10⁴U/mg |
≥2×10⁴U/mg |
|
蛋白含量(BCA法) |
≥0.1mg/mL |
≥1mg/mL |
≥0.1mg/mL |
|
蛋白纯度SDS-PAGE(≥95%) |
√ |
√ |
√ |
|
蛋白纯度SEC-UPLC(≥95%) |
- |
- |
√ |
|
蛋白酶残留(通用底物法) |
- |
√ |
√ |
|
细菌内毒素(凝胶法) |
- |
无 |
<0.25EU/1000U |
|
宿主蛋白残留检测(ELISA法) |
- |
- |
<10ppm(μg/mL) |
|
无菌检测(通则1101) |
- |
- |
√ |
|
病原体(HIV/HBV/HCV)检测(PCR法) |
- |
- |
√ |
|
重金属检测(通则0821) |
- |
- |
√ |
注:检测并合格(√);无检测该指标(-);
|
产品名称 |
货号 |
规格 |
|
20156ES25 |
25 KU |
|
|
20156ES50 |
50 KU |
|
|
20156ES60 |
100 KU |
|
|
20125ES25 |
25 KU |
|
|
20125ES50 |
50 KU |
|
|
20125ES60 |
100 KU |
|
|
20157ES25 |
25 KU |
|
|
20157ES50 |
50 KU |
|
|
20157ES60 |
100 KU |
[1]王兰,王军志.关于生物制品残余DNA质量控制问题[J].中国新药杂志,2011,20(08):678-683+687.


