一、染色质开放研究技术发展史
ATAC-seq作为表观组学研究技术之一,已经被很多组学专家所接受并已经在应用,那关于ATAC-seq技术,你了解多少呢?
要介绍ATAC-seq,不得不提到它的发展史。在染色质开放性研究领域,也是走了一段长长的路,这也是一条长江后浪推前浪的路。
DNase-seq:这项技术属于开放染色质研究的老前辈,它的开发主要是因为染色质区域有很多DNase I HS位点,DNase-seq依赖于DNaseI核酸酶的消化来识别核小体耗尽的开放染色质区域,在那里所有类型的因子都有结合位点,但它不能识别哪些特定的因子被结合【1】。
FAIRE-Seq:FAIRE-Seq的技术开发,其实是在经典DNA-蛋白互作技术ChIP-seq的基础上的技术衍生及应用。2007年,FAIRE-seq技术正式问世,它传承了ChIP-seq的甲醛交联和超声打断,所以整个实验操作时间周期较长,也有一定的实验困难【2-3】。
MNase-Seq也是在ChIP-seq的基础上进行的发展,MNase酶的应用也是在ChIP技术中替代超声的步骤时使用的。MNase-Seq技术是在应用FAIRE-seq时有理有据的迭代更新【4】。
ATAC-seq技术的发展得益于Tn5转座酶的研究,Tn5转座酶的应用,大大简化了开放染色质研究的时间,从最初2-3天的实验周期,缩短到2-3小时【5】。
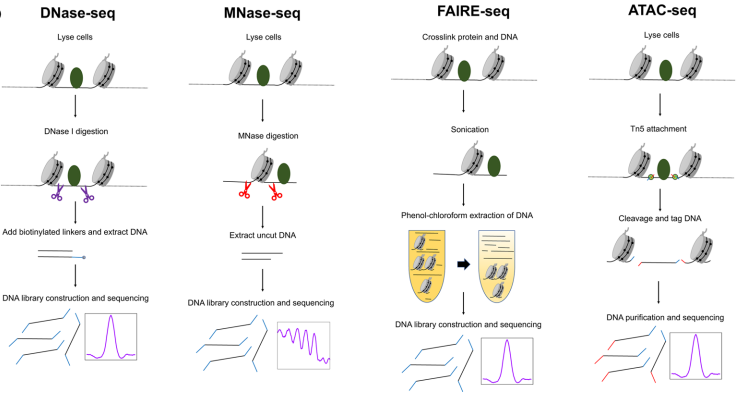
图:不同染色质开放性研究技术对比,图片来源:Lee B. H. et al. 2021
Tn5酶的出现,确实是改变了表观技术研究的应用,ATAC-seq技术问世以来,大量的样本获得了较好的开放染色质区域的信息,转录因子调控更上一层楼。但是,Tn5酶最初的应用,不是在开放染色质研究,而是在DNA文库构建时的酶切片段化,Tn5酶的应用,使得超低浓度DNA建库成为可能,低至1ng的样本都能很好的建库。
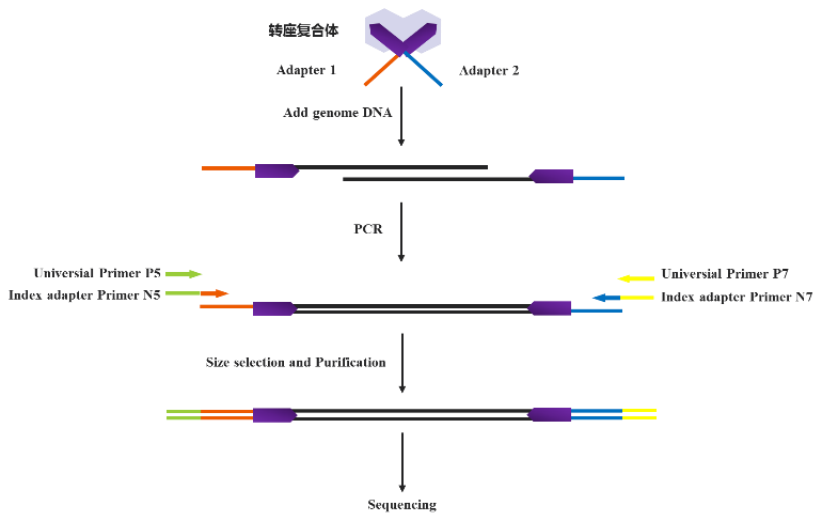
图:基于Tn5酶的建库流程
二、ATAC-seq技术研究要点?
但是在应用时,我们会发现,常规Tn5建库试剂盒,明明是55℃酶切,为什么在进行ATAC-seq研究时,温度就变成了37℃?能不能也进行55℃酶切?实际情况是37℃和55℃都是可以酶切实验,只是在55℃时,有些样本的开放状态可能会有影响,造成后续数据分析时背景噪音较高【7】,而37℃进行实验时,背景噪音普遍较低。当然,我们在真实实验时,也会发现有些样本37℃酶切效果不好时,也是可以考虑改变酶切温度。
除了以上介绍的内容,关于ATAC-seq,到底是在研究什么?数据分析时,要重点关注什么呢?
首先我们从ENCODE上公布的ATAC的数据质量标准来看看关注点:
1)实验需要设置至少2个生物学重复;对无法做生物学重复的样本至少2个技术重复
2)每个实验组需要有单端测序时15 M的clean reads或者双端测序50 M clean reads;
3)mapping率应最低80%;
4)用IDR值评判重复性;
5)NRF>0.9, PBC1>0.9, and PBC2>3评估文库复杂性;
6)peak数50000以上;
7)文库需呈现核小体pattern,至少需要有核小体free的区域展现;
8)FRiP值需大于0.2;
9)TSS分布图来判断背景信号。
总的来说,就是在文库构建之后,需要对文库进行库检,文库需要符合核小体pattern,即呈现出linker峰、一个核小体峰、两个核小体峰等等,然后测序量需要达到要求,另外,测序后的数据分析,peak数是一个评价标准,最后就是TSS分布图来评估背景。
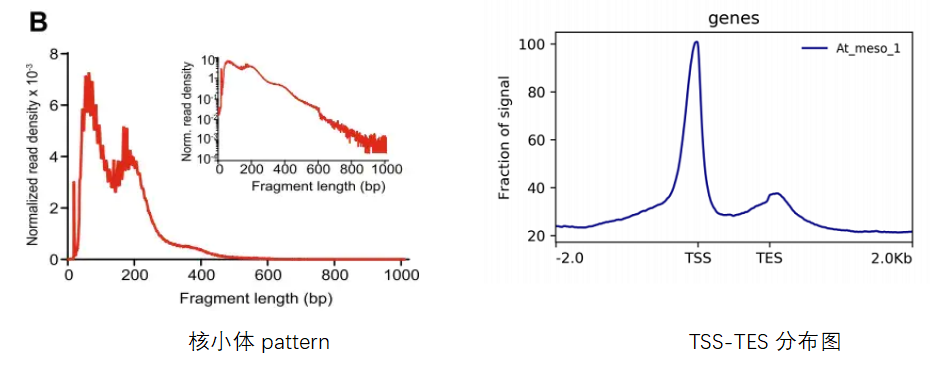
拿到ATAC-seq测序数据之后,我们要去关注什么?ATAC-seq的结果,通常会分两大类,一类是核小体定位,一类是转录因子。发展到现在,关注转录因子的群体越来越多,通过获得的peak进行motif分析,然后预测motif对应的转录因子来进行后续的研究。当然,基于开放染色质区域通常是基因的启动子调控区域,所以将染色质开放区与基于的表达情况进行关系分析,即ATAC-seq+RNA-seq进行关联分析,来找寻关键的转录因子调控的关键靶基因。
当然了,ATAC-seq联合Hi-C以及组蛋白修饰的数据进行增强子鉴定,又是另外一个故事了。
翌圣关联产品速递
|
产品定位 |
产品名称 |
产品编号 |
规格 |
|
ATAC建库试剂盒 |
12208ES12/48 |
12/48 T |
|
|
适合ATAC和CUT&Tag小片段纯化磁珠 |
12600ES03/08 |
1 mL/5 mL |
|
|
Tn5专用接头 |
12416ES |
96 index |
参考文献:
[1] Boyle A P , Davis S , Shulha H P , et al. High-Resolution Mapping andCharacterization of Open Chromatin across the Genome[J]. Cell, 2008, 132(2):311-322.
[2] Giresi P G , Kim J , Mcdaniell R M , et al. FAIRE (Formaldehyde-Assisted Isolation of Regulatory Elements) isolates active regulatory elements from human chromatin[J]. Genome Research, 2007, 17(6):877-885.
[3]Jeremy, M, Simon, et al. Using formaldehyde-assisted isolation of regulatory elements (FAIRE) to isolate active regulatory DNA.[J]. Nature protocols, 2012.
[4] Pajoro A , JM Muiño, Angenent G C , et al. Profiling Nucleosome Occupancy by MNase-seq: Experimental Protocol and Computational Analysis[J]. Methods in Molecular Biology, 2017.
[5] Buenrostro J D , Wu B , Chang H Y , et al. ATAC-seq: A Method for Assaying Chromatin Accessibility Genome-Wide[J]. Current Protocols in Molecular Biology, 2015, 109(1).
[6] Lee B H , Rhie S K . Molecular and computational approaches to map regulatory elements in 3D chromatin structure[J]. Epigenetics & Chromatin, 2021, 14(1).
[7] Zhang H , Rice M E , JW Alvin, et al. Extensive evaluation of ATAC-seq protocols for native or formaldehyde-fixed nuclei[J]. BMC Genomics, 2022, 23(1):1-18.
