产品说明书
FAQ
COA
已发表文献
谷胱甘肽(Glutathione)是一种由3个氨基酸残基(甘氨酸、谷氨酸和半胱氨酸)组成的小肽,保护细胞免受活性氧如自由基和过氧化物引起的细胞损伤。谷胱甘肽在细胞中主要以还原性谷胱甘肽(reduced glutathione, GSH)和氧化型谷胱甘肽(oxidized glutathione disulfide, GSSG)两种形式存在。
GSH是细胞中重要的抗氧化剂,能维持蛋白的还原状态。在谷胱甘肽过氧化物酶(GPx)催化的反应中,两个GSH分子通过巯基脱氢形成二硫键而产生GSSG。此外,谷胱甘肽还原酶(GR)氧化β-烟酰胺腺嘌呤二核苷酸磷酸(β-NADPH2)的同时会将GSSG转变为GSH。在正常细胞中,GSH的含量超过谷胱甘肽总量的90%;当细胞中氧化应激水平上升时,GSSG含量增加,GSH/GSSG比例下降,所以,GSH/GSSG比例可做为细胞中氧化应激水平的指标。
该试剂盒采用了一种特殊的非荧光染料,通过与GSH反应发出强烈荧光(Ex/Em=490/520 nm),可定量分析样品中的GSH含量;也可通过GSSG Probe将GSSG还原成GSH,定量分析样品中的GSSG含量。该试剂盒灵敏度高,可以在100 µL测定体积中检测到少至1 pM的GSH或GSSG。
产品组分
|
组分编号 |
组分名称 |
组分规格 |
储存条件 |
|
50120-A |
Thiolite Green |
1 vial |
-20℃ |
|
50120-B |
Assay Buffer |
25 mL×1 |
-20℃ |
|
50120-C |
GSH Standard |
1 vial (62 µg) |
-20℃ |
|
50120-D |
DMSO |
400 μL×1 |
-20℃ |
|
50120-E |
GSSG Probe |
1 vial |
-20℃ |
|
50120-F |
GSSG Standard |
1 vial (124 µg) |
-20℃ |
【注】:50120-E组分(GSSG Probe)配置后须在2 h以内使用完毕。
运输和保存方法
冰袋运输。避光保存于-20℃,有效期1年。
注意事项
- 荧光染料均存在淬灭问题,请尽量注意避光,以减缓荧光淬灭。
- 为了您的安全和健康,请穿实验服并戴一次性手套操作。
- 粉末溶解前请先短暂离心,以保证产品全在管底。
- 请勿吸入、吞咽或者直接接触皮肤和眼睛。
- 本产品仅用于科研用途。
实验过程
1 试剂准备
① GSH标准品母液(1 mM):将200 μL Assay Buffer(B组分)加入GSH Standard(C组分)中制备1 mM GSH标准品母液,用时置于冰上,未用完的分装-20°C保存,避免反复冻融。
② GSSG标准品母液(1 mM):将200 μL ddH2O加入GSSG Standard(F组分)中制备1 mM GSSG标准品母液,用时置于冰上,未用完的分装-20°C保存,避免反复冻融。
③ Thiolite Green母液(100×):将100 μL DMSO(D组分)逐滴加入Thiolite Green(A组分)中,涡旋振荡混匀,制备100×Thiolite Green母液,用时置于冰上,未用完的分装-20°C避光保存,避免反复冻融。
【注】:为充分溶解也可用200 μL DMSO配置成50×Thiolite Green母液。
④ GSH工作液:向100 μL Thiolite Green母液(100×)中加入10 mL Assay Buffer(B组分),混匀。
【注】:相当于两个96孔板的检测用量,请根据实际情况进行调整。GSH工作液在室温下不稳定,注意避光,并在配置后2 h以内使用。
⑤ Total GSH工作液:将5 mL的GSH工作液加入到GSSG Probe(E组分),涡旋振荡混匀。
【注】:相当于1个96孔板的检测用量,请根据实际情况进行调整。Total Glutathione工作液在室温下不稳定,注意避光,并在配置后2 h以内使用。
2 GSH和GSSG标准液准备
2.1 向10 μL的GSH标准母液(1 mM)中加入990 μL的Assay Buffer(B组分)配置10 μM GSH标准液;然后用Assay Buffer(B组分)按1:1比例依次稀释200 μL的10 μM GSH标准液以制备5 μM、2.5 μM、1.25 μM、0.625 μM、0.3125 μM和0.1563 μM的GSH标准液。
2.2 向10 μL的GSSG标准母液(1 mM)中加入990 μL的Assay Buffer(B组分)配置10 μM GSSG标准液;然后用Assay Buffer(B组分)按1:1比例依次稀释200 μL的10 μM GSSG标准液以制备5 μM、2.5 μM、1.25 μM、0.625 μM、0.3125 μM、0.1563 μM和0.0781 μM的GSSG标准液。
【注】:稀释的GSH和GSSG标准液不稳定,需要在配置后4 h以内使用。
3 样本制备
3.1 细胞样本:尽量使用新鲜样本。收集104-105个细胞,预冷PBS润洗后,加入100 μL裂解液(0.5% NP-40 in PBS, pH4-6),冰上裂解,12,000g 4℃离心15 min取上清,去蛋白处理(见3.4)后用于检测。
3.2 组织样本:取20 mg组织样本,预冷PBS润洗后,加入400 μL裂解液(0.5% NP-40 in PBS, pH4-6),冰上匀浆,12,000g 4℃离心15 min取上清,去蛋白处理(见3.4)后用于检测。
3.3 血浆、血清、血液和尿液样本:使用新鲜样本,去蛋白处理(见3.4)后,用于GSH/GSSG的测定。
3.4 样本去蛋白处理:组织、细胞和生物液体中可能存在干扰检测的蛋白酶类,可使用TCA/NaHCO3方法来去除蛋白。向样本中加入5倍体积预冷的100% TCA,混匀后冰上孵育5-10 min,12,000g 4℃离心5 min取上清,然后逐滴加入NaHCO3溶液中和至pH为4-6,取1 μL样品用pH试纸进行测定;13,000g 4℃离心15 min取上清用于GSH/GSSG的测定。
【注】:避免中和后的溶液pH超过7,因为GSH不稳定,在pH>7时容易被氧化。
4 检测GSH和Total GSH含量
4.1向黑色平底孔板中加入相应体积的标准液、待测样本和空白对照(使用Assay buffer,组分B),见Table1;对于96孔板,每孔加入50 μL标准液或待测样本,总测定体积为100 μL/孔;对于384孔板,每孔加入25 μL标准液或待测样本,总测定体积为50 μL/孔。
Table 1. Layout of GSH standards, GSSG standards, Blank Control and test samples in a solid black 96-well microplate.
|
Panel A: For GSH |
Panel B: For Total GSH |
||||||
|
BL |
BL |
TS |
TS |
BL |
BL |
TS |
TS |
|
GSH1 |
GSH1 |
… |
… |
GSSG1 |
GSSG1 |
… |
… |
|
GSH2 |
GSH2 |
… |
… |
GSSG2 |
GSSG2 |
… |
… |
|
GSH3 |
GSH3 |
|
|
GSSG3 |
GSSG3 |
|
|
|
GSH4 |
GSH4 |
|
|
GSSG4 |
GSSG4 |
|
|
|
GSH5 |
GSH5 |
|
|
GSSG5 |
GSSG5 |
|
|
|
GSH6 |
GSH6 |
|
|
GSSG6 |
GSSG6 |
|
|
|
GSH7 |
GSH7 |
|
|
GSSG7 |
GSSG7 |
|
|
GSH = GSH Standard (GSH1 - GSH7, 0.1563 to 10 µM), GSSG = GSSG Standard (GSSG1 - GSSG7, 0.0781 to 5 µM), BL = Blank Control, TS = Test Sample
4.2 对于测定GSH含量(Panel A),向GSH标准液、待测样本和空白对照中加入同等体积GSH工作液。
4.3 对于测定Total GSH含量(Panel B),向GSSG标准液、待测样本和空白对照中加入等体积Total GSH工作液。
4.4 混匀后,室温孵育10-60 min。
4.5 荧光酶标仪下测量荧光读值,Ex/Em = 490/520 nm。
【注】:如果样本荧光过高,注意稀释样本后再进行检测。
数据分析
1 从空白标准孔获得的读数用作阴性对照。从其他标准的读数中减去该值,以获得基线校正值,荧光背景会随时间而增加,因此标准品和测试样本的荧光读值计算前需减去空白孔的荧光强度值。然后,绘制标准读数以获得标准曲线和方程。该方程可以用于计算样本中GSH和Total GSH含量。
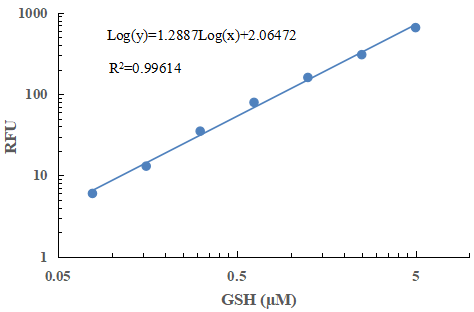
图1 GSH标准曲线
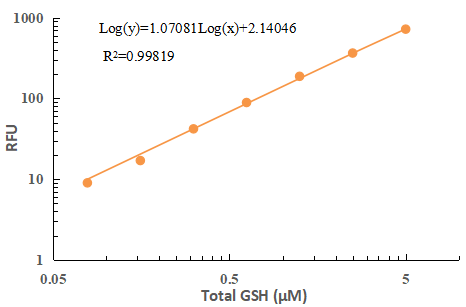
图2 Total GSH标准曲线(横坐标为GSSG标准液浓度(0.0781-2.5 µM)换算成相应GSH浓度)
2 通过Panel A GSH的标准曲线计算样本中GSH的含量,注意样本制备过程中的稀释倍数。
3 通过Panel B GSSG的标准曲线计算样本中Total GSH的含量,注意样本制备过程中的稀释倍数。
4 由于1 mole的GSSG能转化成2 mole的GSH,GSSG= (Total GSH- GSH)/2。
HB221229



