产品说明书
FAQ
COA
已发表文献
烟酰胺腺嘌呤二核苷酸(NAD,辅酶Ⅰ)是细胞中常见的重要辅因子,通过电子交换参与各种代谢反应。NADH(还原性辅酶I)是NAD的还原态。在氧化还原反应中,NADH作为氢和电子的供体,NAD作为氢和电子的受体,参与多种生理过程。NAD/NADH比率可以反应细胞中氧化还原状态。
该试剂盒适用于测定NAD和NADH,背景低,灵敏度高。NADH可以将探针还原为高荧光产物,其信号可以通过荧光酶标仪在Ex/Em = 540/590 nm或在比色测定(OD =576 nm)中定量。
产品组分
|
组分编号 |
组分名称 |
组分规格 |
储存条件 |
|
50130-A |
NAD/NADH Recycling Enzyme Mix |
2 vials |
-20℃ |
|
50130-B |
NADH Sensor Buffer |
20 mL×1 |
-20℃ |
|
50130-C |
NADH Standard |
1 vial (142 µg) |
-20℃ |
|
50130-D |
NADH Extraction Solution |
10 mL×1 |
-20℃ |
|
50130-E |
NAD Extraction Solution |
10 mL×1 |
-20℃ |
|
50130-F |
NAD/NADH Control Solution |
10 mL×1 |
-20℃ |
|
50130-G |
NAD/NADH Lysis Buffer |
10 mL×1 |
-20℃ |
运输和保存方法
冰袋运输。避光保存于-20℃,有效期1年。
注意事项
1 荧光染料均存在淬灭问题,请尽量注意避光,以减缓荧光淬灭。
2 为了您的安全和健康,请穿实验服并戴一次性手套操作。
3 粉末溶解前请先短暂离心,以保证产品全在管底。
4 请勿吸入、吞咽或者直接接触皮肤和眼睛。
5 本产品仅用于科研用途。
实验过程
1 试剂准备
① NADH标准品母液(1 mM):将200 μL PBS (pH 7.4)加入NADH Standard(C组分)中制备1 mM NADH标准品母液,用时置于冰上,未用完的分装-20°C保存,避免反复冻融。
② NADH梯度标准液(0-10 μM):将970 μL PBS (pH 7.4)加入到30 μL NADH标准母液(1 mM)中制备30 μM NADH标准液,然后取200 μL的30 μM NADH标准液按照1:3的比例用PBS (pH 7.4)稀释成NADH梯度标准液(10 μM, 3.33 μM, 1.11 μM, 0.37 μM, 0.123 μM, 0.0411 μM)。
【注】:稀释后的NADH标准液不稳定,应该配置后4 h内使用。
③ NAD/NADH反应液:向每瓶NAD/NADH Recycling Enzyme Mix(组分A)中加入10 mL NADH Sensor Buffer(B组分),混匀。
【注】:相当于96孔板的125次测试的检测用量。NAD/NADH反应液不稳定,注意避光并尽快使用,未用完的分装-20°C保存。
④ NAD/NADH Lysis Buffer(组分G):用前恢复至室温。
2 样本制备
2.1 细胞样本:收集0.5-1×107个细胞,预冷PBS润洗后,加入100 μL NAD/NADH Lysis Buffer(组分G),37°C孵育15 min,1500 rpm室温离心5 min,取上清检测。
2.2 组织样本:取20 mg组织样本,预冷PBS润洗后,加入400 μL NAD/NADH Lysis Buffer(组分G),室温匀浆,2500 rpm室温离心5 -10 min,取上清检测。
2.3 细菌样本:4°C 10,000 g离心15 min收集细菌,每107个细菌加入1 mL NAD/NADH Lysis Buffer(组分G),室温孵育15 min,2500 rpm室温离心5 -10 min,取上清检测。
2.4 植物样本:取200 mg叶片,加入1 mL NAD/NADH Lysis Buffer(组分G),室温匀浆,2500 rpm室温离心5 -10 min,取上清检测。
【注】:建议使用新鲜样本,如果无法及时进行检测,样本建议存于-80 °C,检测时冰上解冻,但是检测的荧光值可能会降低。不要使用RIPA裂解液,因为RIPA裂解液会干扰检测。如果样本中NADH含量高,注意稀释样本。
3 检测过程
3.1 如下图,向96孔黑色平底孔板中加入25 μL的NADH标准液、待测样本或空白对照(PBS)。
Table 1. Layout of NADH standards, Blank Control and test samples in a solid black 96-well microplate.
|
BL |
BL |
TS (Total) |
TS (Total) |
TS (NADH) |
TS (NADH) |
TS (NAD) |
TS (NAD) |
|
NS1 |
NS1 |
… |
… |
|
|
… |
… |
|
NS2 |
NS2 |
… |
… |
|
|
… |
… |
|
NS3 |
NS3 |
|
|
|
|
|
|
|
NS4 |
NS4 |
|
|
|
|
|
|
|
NS5 |
NS5 |
|
|
|
|
|
|
|
NS6 |
NS6 |
|
|
|
|
|
|
|
NS7 |
NS7 |
|
|
|
|
|
|
NS= NADH Standard, BL = Blank Control, TS (Total) = Test Sample treated with NAD/NADH Control Solution , TS (NADH) = test sample treated with NADH Extraction Solution, then neutralized by NAD Extraction, TS (NAD) = test sample treated with NAD Extraction Solution, then neutralized by NADH Extraction Solution
3.3 对于NAD的提取TS (NAD):向待测样本中加入25 μL NAD Extraction Solution(组分E),室温孵育10-15 min,再加入25 μL NADH Extraction Solution(组分D)中和。3.2 对于NADH的提取TS (NADH):向待测样本中加入25 μL NADH Extraction Solution(组分D),室温孵育10-15 min,再加入25 μL NAD Extraction Solution(组分E)中和。
3.4 对于总NAD和NADH检测TS (Total):向待测样本中加入25 μL NAD/NADH Control Solution(组分F),室温孵育10-15 min,再加入25 μL NAD/NADH Control Solution(组分F)。
3.5 对于NADH标准液NS1-7:向NADH标准液中加入25 μL NAD/NADH Control Solution(组分F),室温孵育10-15 min,
再加入25 μL NAD/NADH Control Solution(组分F)。
Table 2 Reagent composition for each well
|
Well |
Reagent |
Treatment |
Incubate at RT 10-15 min |
Treatment |
Total Volume |
|
NS1-7 |
25 μL NADH Standard (0-10 μM NADH) |
25 μL F |
25 μL F |
75 μL |
|
|
BL |
25 μL PBS (pH 7.4) |
25 μL F |
25 μL F |
75 μL |
|
|
TS (Total) |
25 μL Test sanmple |
25 μL F |
25 μL F |
75 μL |
|
|
TS (NADH) |
25 μL Test sanmple |
25 μL D |
25 μL E |
75 μL |
|
|
TS (NAD) |
25 μL Test sanmple |
25 μL E |
25 μL D |
75 μL |
3.6 每孔中加入75 μL NAD/NADH反应液(测试总体积150 μL),混匀后,室温避光孵育15 min-2 h。
3.7 荧光酶标仪下测量荧光读值(Ex/Em=540/590 nm);也可以使用白色透明96孔板,使用酶标仪在OD=576±5nm的波长下读数,但灵敏度低于荧光检测。
【注】:高浓度的NADH(终浓度>300 μM)会导致荧光读值下降,因为NADH sensor被过度氧化,生成非荧光产物。
数据分析
1 从空白标准孔获得的读数用作阴性对照。从其他标准的读数中减去该值,以获得基线校正值,荧光背景会随时间而增加,因此标准品和测试样本的荧光读值计算前需减去空白孔的荧光强度值。然后,通过绘制标准读数以获得标准曲线和方程。
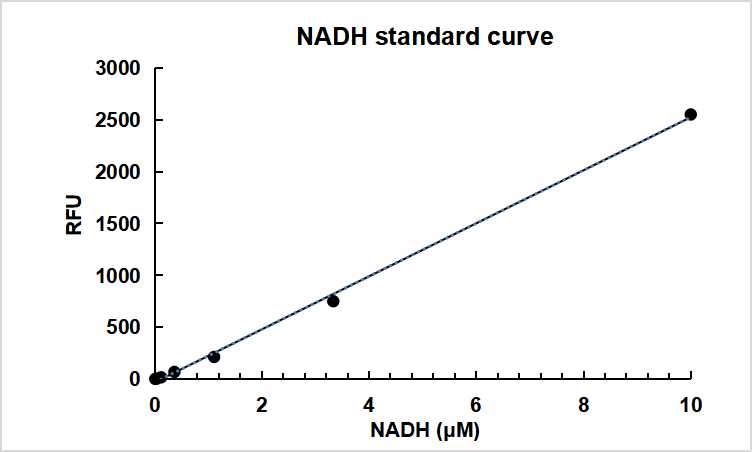
图1 NADH标准曲线
加入75 μL NAD/NADH反应液后室温避光孵育30 min后,荧光酶标仪下测量荧光读值。
2 样本中NAD含量计算公式:NAD concentration = (B/V)×D。B代表根据标曲计算出的测试样本中NAD的含量(μM),V代表测试样本体积(μL),D代表测试样本稀释倍数。
3 样本中总NAD和NADH含量计算公式:Total concentration = (B/V)×D。B代表根据标曲计算出的测试样本中总的NAD和NADH的含量(μM),V代表测试样本体积(μL),D代表测试样本稀释倍数。
4 在健康的哺乳动物细胞中,NAD比NADH多,因此我们建议使用总NAD和NADH含量减去NAD来计算NADH的量。
HB221230



