新品上市│E.coli poly (A) Polymeras

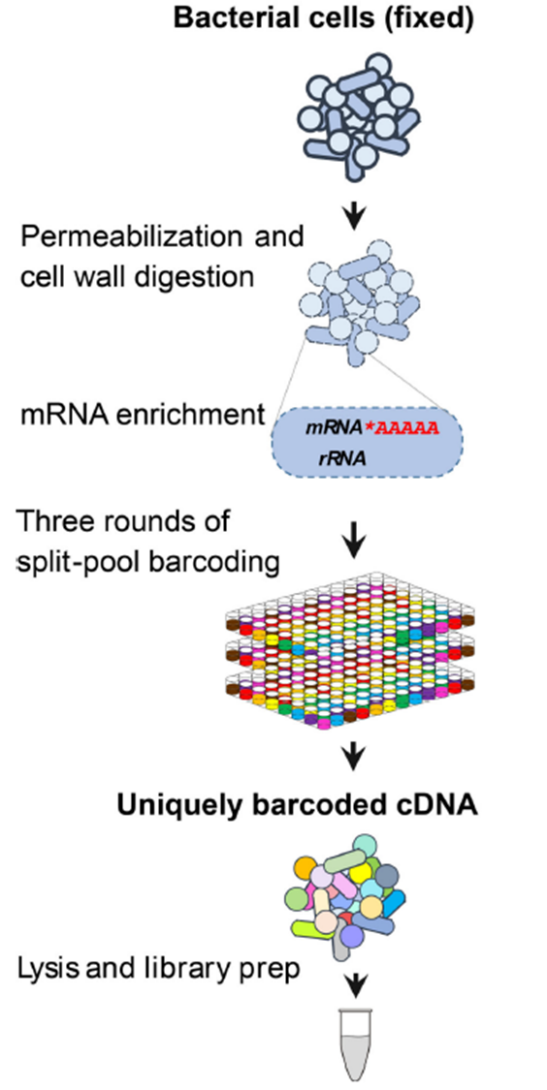
微生物单细胞测序
mRNA体外转录
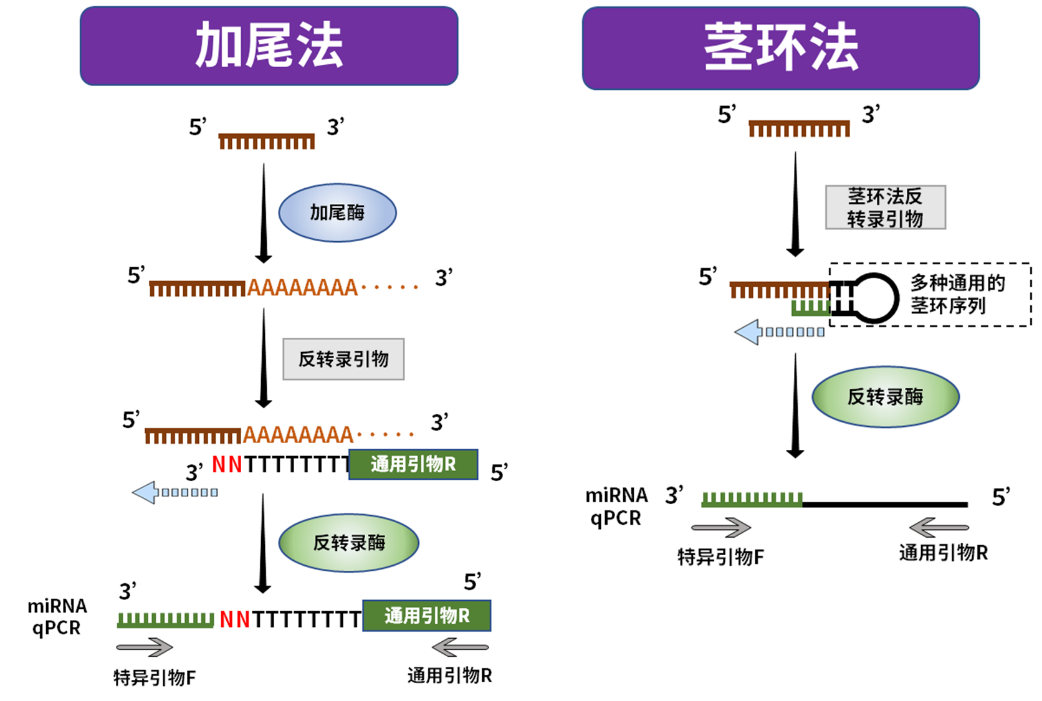
表1.加尾方式比较

miRNA表达分析
数据展示
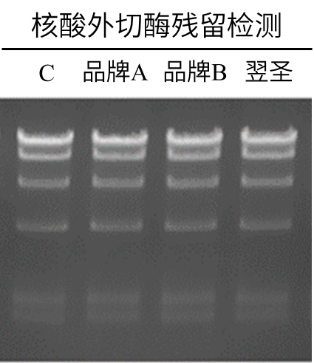
图4. 核酸外切酶残留检测。将15 U poly(A) Polymerase和0.5 μg λDNA-HindⅢ digest于37℃孵育2小时,
结果显示翌圣E.coli poly(A) Polymerase(Cat#14801)核酸外切酶残留水平与进口品牌一致。
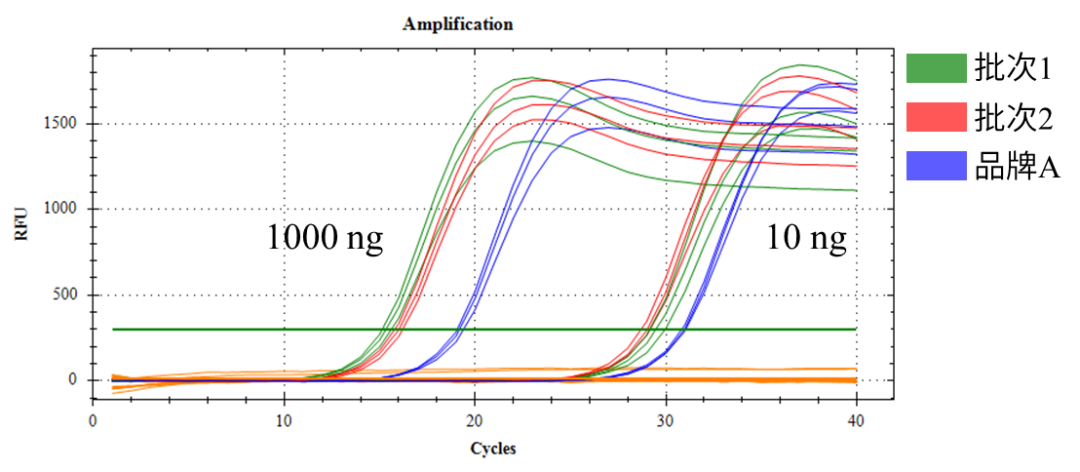
图5. 以10ng、1000ng人源总miRNA为模板,使用翌圣E.coli poly(A) Polymerase(Cat#14801)进行加尾法反转录,获得的cDNA进行qPCR检测。
结果显示翌圣E.coli poly(A) Polymerase应用于miRNA反转录,灵敏度优于品牌A。
相关产品
|
产品定位 |
产品名称 |
产品货号 |
|
加尾法酶 |
14801ES |
|
|
加尾反应原料 |
10129ES |
|
|
加尾法反转定量 |
11148ES |
|
|
11171ES |
参考文献
