作为一名实验人员,载体构建你一定不陌生,而T4 DNA连接酶负责将目的片段连接到载体上,正是决定实验成功的关键元素之一。那么T4 DNA连接酶在分子克隆实验中起到什么作用呢?又是怎么起作用的呢?除了载体构建,T4 DNA连接酶还能在那些实验中发挥作用呢?下面小翌就来带你更全面的认识T4 DNA 连接酶。
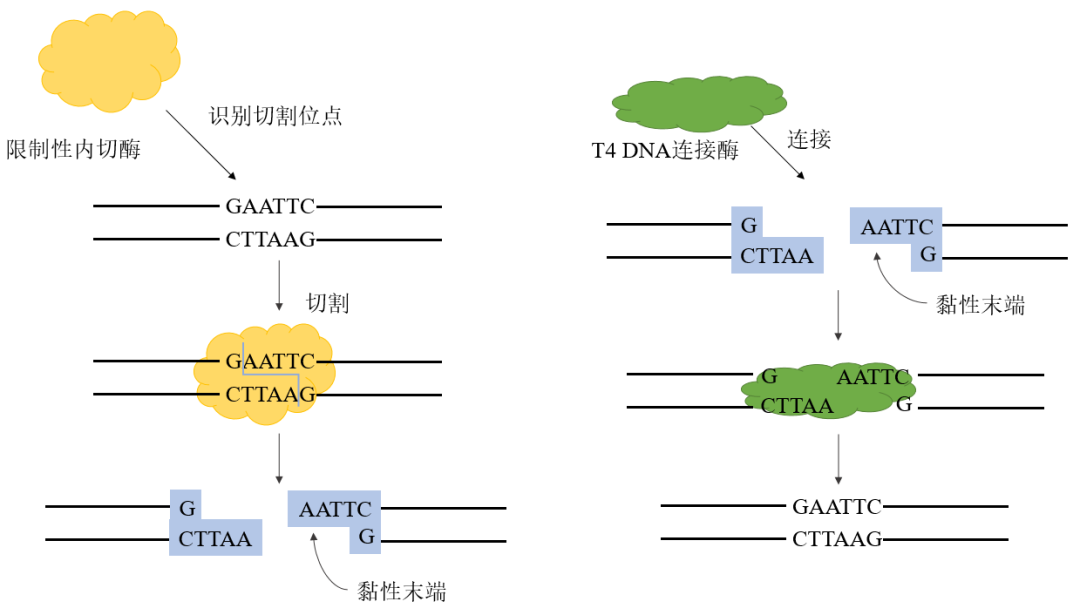
基因工程中用到的连接酶主要是大肠杆菌DNA连接酶以及T4 DNA连接酶,目前后者的应用更为广泛。T4 DNA连接酶可以修补双链DNA、双链RNA或DNA/RNA杂合链上的单链切口,使两个相邻的核苷酸连接起来,在DNA修复和重组中起着重要的作用。
在传统的酶切酶连法载体构建过程中,T4 DNA连接酶可以搭配限制性内切酶一起完成酶切酶连实验。它可以催化双链DNA的5’-P末端和3’-OH末端之间形成磷酸二酯键,并且对黏性末端连接和平末端连接都有不错的连接效率,适用性广,使用者也比较多。
在载体构建实验中,选择不同的限制性内切酶,可以产生不同类型的末端。针对不同的末端,T4 DNA连接酶会有不同的连接策略。
在载体构建过程中,如果使用同一种限制性核酸内切酶切割目的基因DNA片段和载体分子可以产生相同的黏性末端,T4 DNA连接酶可以将直接进行重组连接。但是因为黏性末端相同,目的基因正向或者反向都可以接入载体,这样容易增加筛选正确重组克隆的工作量,可以考虑使用双酶切的方法进行载体构建。
此外,单酶切制备的载体,自身的黏性末端也可以进行配对,进而在T4 DNA连接酶的作用下在核苷酸之间形成磷酸二酯键,发生载体自连。使用碱性磷酸酶处理酶切后的载体可以将载体5’端的磷酸基团去掉,这样载体就无法完成自连,从而在T4 DNA连接酶的作用下和目的片段连接,完成重组载体的构建。
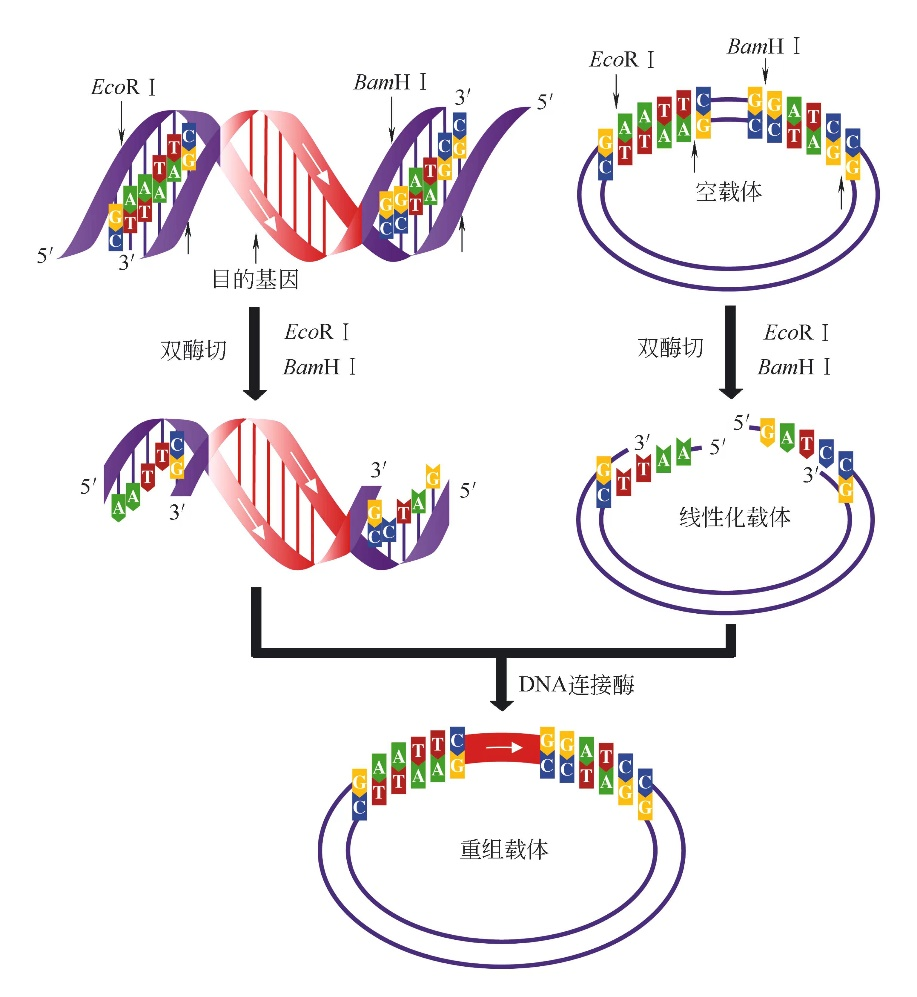
在载体构建过程中,如果使用两种具有不同黏性末端的限制性内切酶分别酶切目的片段和载体,就可以产生两种不同的黏性末端。此时,T4 DNA连接酶可选择性的将相同的黏性末端连接起来,从而确保目的片段以正确的方向接入载体。图2中的目的片段和载体同时使用EcoR Ⅰ和BamH Ⅰ进行酶切时,同样的黏性末端才能彼此连接,目的片段和载体之间只存在一种连接方向。
有的限制性内切酶在酶切时也可以产生平末端,例如Sma I 等。T4 DNA连接酶可以直接在载体和目的片段之间形成磷酸二酯键,碱基之间不再需要配对,但是这种方式连接效率很低且容易发生载体自连。一般可以将平末端转为转成黏性末端后进行连接,例如利用末端转移酶分别在目的片段和载体的末端上添加互补的多聚A和多聚T碱基,人工添加黏性互补末端,这种方式可以提高连接效率。
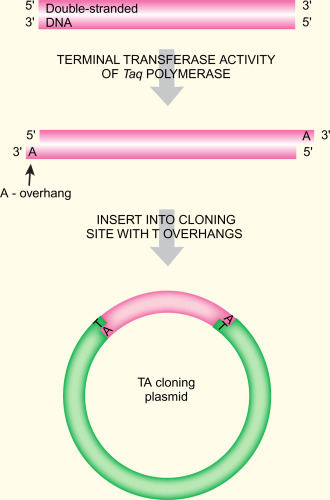
TA克隆中用到的T载体3’端有一个突出的T碱基,在不清楚目的片段DNA序列时,可以通过TA克隆的方式将将目的基因片段与T载体连接起来,最终测序确定目的基因序列。PCR中常用的Taq DNA聚合酶具有末端转移酶的活性,可以在DNA片段的3’端添加一个核苷酸,通常为A。使用T4 DNA连接酶,即可将Taq DNA聚合酶扩增的产物与T载体进行黏性末端互补连接,不需要再对PCR扩增产物加接头等处理即可达到高效克隆的目的。
注:若需要进一步提高连接效率,简化连接步骤,可以选择同源重组的方式,推荐Cat#19022。
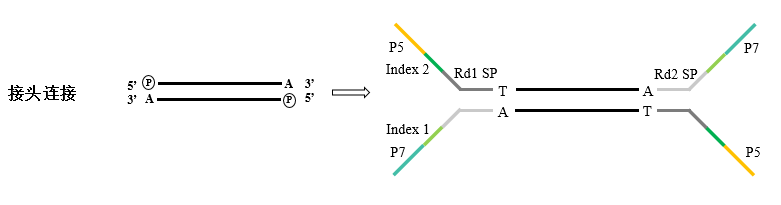
在二代测序文库构建过程中,需要将人为构建的接头连接至PCR产物上,才能固定至测序芯片上的flowcell上完成测序。其中TA克隆连接接头建库是很常见的技术手段,它的原理与上述中TA克隆相似,待测序DNA片段在5'端磷酸化和3'端加“A”后,与带“T”黏性末端的接头互补配对,从而形成一个可上机测序的完整双链。
在进行TA连接时,不同样本类型或核酸片段结构的复杂程度都会影响到连接的效率,因此不同平台的接头也会有所影响。比如华大平台的Bubble接头,这种接头具有特殊的二级结构,对于T4 DNA 连接酶的连接效率要求非常高,而连接效率的降低直接影响到最终文库的产出。
翌圣针对NGS建库过程中DNA片段和接头连接专门开发了Fast T4 DNA连接酶。该酶具有高效的连接能力,不仅连接速度快,而且兼容各类样本,对于复杂结构核酸片段的连接更显优势。目前已经过大量客户的高通量测序验证,对于华大平台的Bubble接头的连接,也可得到稳定的测序质量。
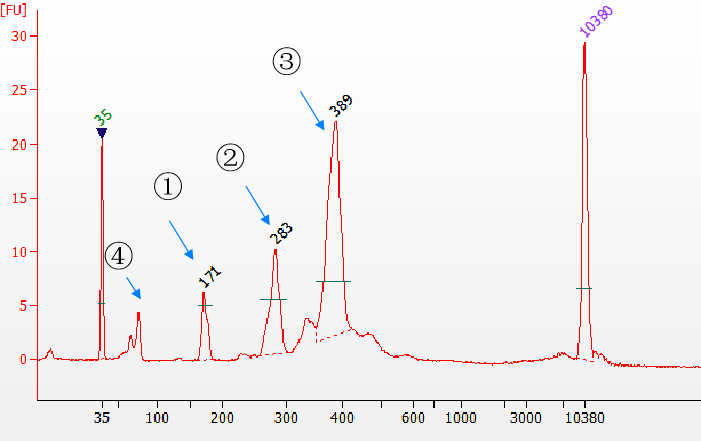
1. 超高的连接效率:使用翌圣Fast T4 DNA连接酶进行不同接头类型末端的文库构建,样本为170 bp cfDNA模拟物,使用Agilent 2100文库检测结果。未连接接头产物;单端接头连接产物;③双端接头连接产物;④残留接头。从结果可以看到单端以及双端接头的连接效率都非常高。
图5. 不同类型连接产物通过Agilent 2100检测结果图
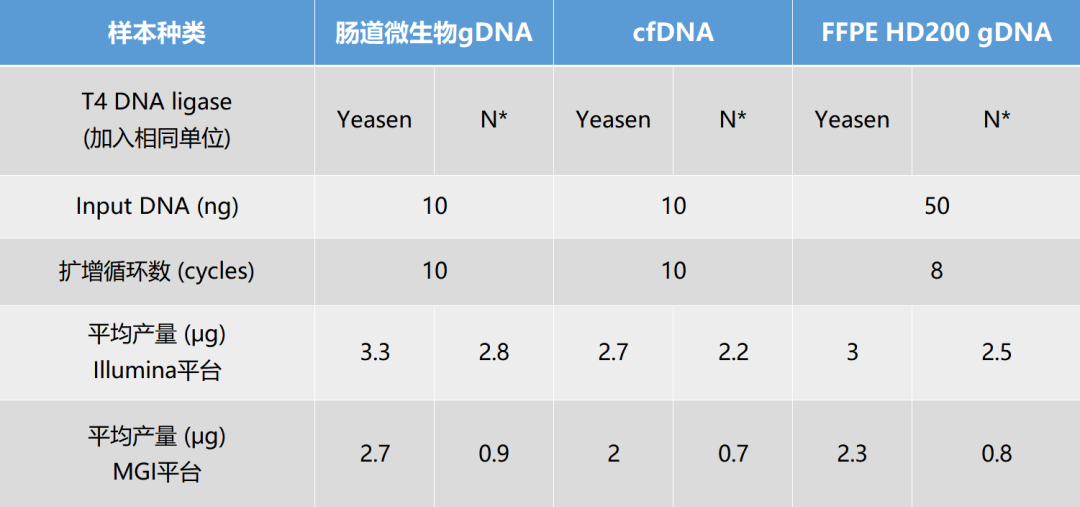
2. 优异的文库产量:使用Fast T4 DNA连接酶进行不同种类文库构建,对比市面其他T4 DNA连接酶,都有更好的文库产量。
除了Fast T4 DNA连接酶,翌圣还有Novel T4 DNA连接酶、Quick T4 DNA 连接酶可供选择。
1. 袁婺洲.《基因工程(第二版)》:化学工业出版社,2019
2. Clark D P, Pazdernik N J, Mcgehee M R. Cloning Genes for Synthetic Biology - ScienceDirect[J]. Molecular Biology (Third Edition), 2019:199-239.
3. Tomkinson A E, Vijayakumar S, Pascal J M, et al. DNA Ligases: Structure, Reaction Mechanism, and Function[J]. Chemical Reviews, 2010, 37(21):no-no.
4. Shuman S. DNA Ligases: Progress and Prospects[J]. Journal of Biological Chemistry, 2009, 284(26):17365-17369.