Annexin V-FITC/PI细胞凋亡检测试剂盒是用FITC标记的Annexin V作为探针,来检测细胞早期凋亡的发生,是细胞凋亡检测实验中最常用的一种探针组合。
在细胞凋亡早期阶段,细胞膜内侧的磷脂酰丝氨酸(PS)从胞质转至胞外,暴露在细胞外环境中,细胞膜通透性增加,从而被PS特异的Annexin-V探针标记。
Annexin-V为Ca2+依赖性磷脂结合蛋白,对PS有极强的结合力。PI是一种经济、稳定的核酸染料,它不能透过正常细胞或早期凋亡细胞的完整的细胞膜,但可以透过凋亡晚期和坏死细胞的细胞膜而使细胞核染红。
将Annexin V与PI联合使用时,PI被排除在活细胞和早期凋亡细胞之外,而晚期凋亡细胞和坏死细胞同时被FITC和PI结合染色呈现双阳性。
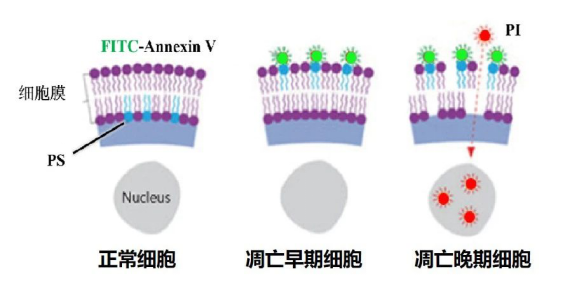
图1. Annexin V-FITC/PI细胞凋亡检测原理
流式细胞仪分析:
FITC最大激发波长为488 nm,最大发射波长525 nm,FITC的绿色荧光在FL1通道检测;
PI-DNA复合物的最大激发波长为535 nm,最大发射波长为615 nm,PI的红色荧光在FL2或FL3通道检测。

图2. Annexin V-FITC/PI细胞凋亡检测结果
在凋亡实验中,经常会出现假阳性或与预期结果不符的情况,可能的原因有补偿调节不当、细胞浓度过高、消化过度、药物干扰、药物处理时间过长、样本自身问题等多个方面,接下来,小翌就带您一起看看该如何得到一张完美的结果图。
荧光素被激光激发后发出不同波长的荧光,理论上每一种荧光通过选择恰当的滤光片可被相应的检测器检测到,而不受其他荧光的干扰。但目前这些荧光染料都具有宽发射谱性质,尽管它们的发射峰各不相同,但发射谱范围有一定的重叠【1】,也就是说,相邻的检测器会检测到彼此的荧光信号,这样就影响了检测结果的准确性,因此,多色分析时必须进行光谱重叠的校正。【2】
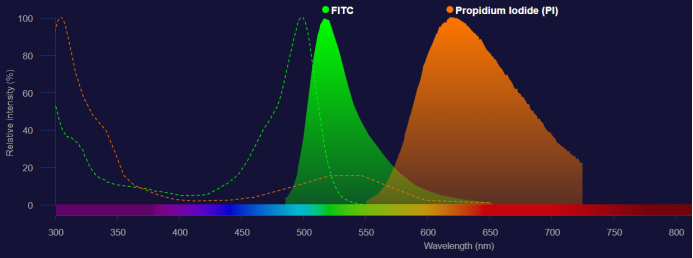
图3. FITC和PI的发射光谱
调节方法:设置对照
空白管:诱导凋亡的细胞不加染料,用来调节荧光通道的光电倍增管电压;
单染管:分别需要只加PI和荧光标记的Annexin V两个单染管,用来调节2个荧光通道的补偿值;
荧光素之间的补偿值应保持恒定;双荧光染色时,如果一个荧光很强,而另一个很弱,则一定要做补偿;补偿只应用在同一个激光激发的不同荧光素之间,避免补偿不足和过度补偿。【3】
细胞浓度过高,培养基消耗过快,导致细胞饥饿发生凋亡。因此在做细胞凋亡处理前,应尽量使细胞处在最佳状态,再进行细胞凋亡诱导处理,避免细胞本身的衰老引起的凋亡。
图4. 细胞浓度过高导致细胞自发凋亡,空白对照(左),实验组(右)
对贴壁细胞,消化是最关键的步骤,消化液需用不含EDTA的胰酶,因为Annexin V和PS的结合需要Ca2+,而EDTA是Ca2+ 螯合剂,使用含有EDTA的胰酶会造成假阴性。细消化时可以将胰酶铺满孔板底后,轻摇使胰酶与细胞充分接触,然后倒掉大部分胰酶,利用剩余少量胰酶再消化一段时间,待细胞间空隙增大,瓶底呈花斑状即可终止,吹打细胞要轻柔,过度消化和机械损伤都会引起细胞膜的损伤,造成假阳性。
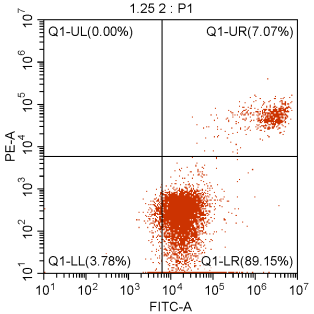
图5. 细胞消化过度导致早期凋亡细胞占89.15%
下图中可以看出,未经处理的空白对照组(左)早期凋亡占3.38%,晚期凋亡细胞占6.64%,而右图中Q1和Q2中的细胞占90%,几乎所有细胞都在PI通道产生荧光,判断是药物带来的荧光干扰。因此,在选择试剂盒时,应尽量避开药物和细胞自带的荧光信号。
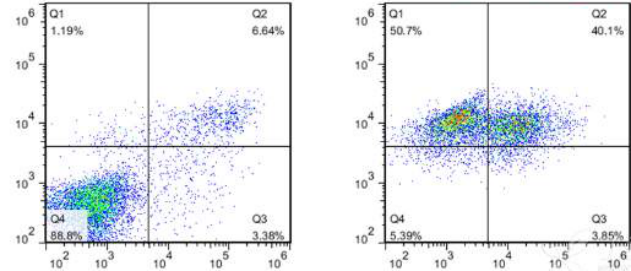
图6. 药物自身的荧光干扰:空白对照(左)和经过药物处理的细胞(右)
样品处理完毕后应进快进行流式检测。样品处理时间过长,也容易导致细胞进入晚期凋亡和坏死阶段,如下图,空白对照组结果正常,但是药物处理组出现大量凋亡晚期细胞,考虑是药物处理时间过长导致。
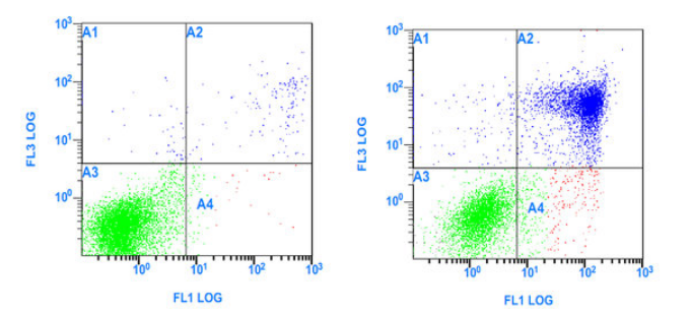
图7. 药物处理时间过长:空白对照(左)和经过药物处理的细胞(右)
神经细胞膜容易破坏外翻,导致假阳性,所以Annexin V/PI 双染法流式检测细胞凋亡不适用于神经细胞。
如果样品来源于血液,请务必除去血液中的血小板。因为血小板含有PS,能与Annexin V结合,从而干扰实验结果。可以使用含有EDTA的缓冲剂并在200 g离心洗去血小板。
【1】Pietkiewicz S , Schmidt J H , Lavrik I N . Quantification of apoptosis and necroptosis at the single cell level by a combination of Imaging Flow Cytometry with classical Annexin V/propidium iodide staining[J]. Journal of Immunological Methods, 2015, 423:99-103.
【2】陈军浩, 刘勇, 邹征云,等. 流式细胞术Annexin V/PI检测细胞凋亡阳性界线值及补偿值的确定[J]. 现代检验医学杂志, 2008(04):24-27.
【3】王辉, 高颖. 应用流式细胞仪的常见问题及解决对策[J]. 现代仪器与医疗, 2012(01):64-65.
相关产品——翌圣Annexin V/PI 系列试剂盒
HB201203







