“开弓没有回头箭”,核酸质量是分子实验成功的基础!
核酸提取是实验室最常见实验,我们经常会抽提基因组或总RNA,少则几份,多则上百份。准备提取材料,加入TRIzol或裂解液,加入氯仿、异丙醇,纯化柱进行核酸沉淀和洗涤、洗脱,半小时后就可以得到核酸样本。
因为提取实验太平常,以至于我们从来没有思考过这个实验背后的问题。大家通常测浓度、测比值,而教科书中已明确告知我们测出来数值(纯粹核酸的比值范围是固定的)代表了核酸品质,但偏离标准范围的数值往往被忽视,对实验结果的影响往往得不到很好的解释,实验室为之付出的代价,要比想象中大的多!
Part I :看了这些案例,我决定评估模板质量了!
核酸多发挥模板属性,被用于倍数扩增调取或富集目标序列。
以荧光定量PCR实验来看,荧光定量PCR实验是一个多步骤的实验技术,在整个实验过程中,核酸提取无论在所花时间占比或实验精细化程度(如所需设备及试剂)上,似乎都不够看的。然而凡是多步骤的实验,每一步都很关键,如精密化的芯片制造一样,工序一千起步,这就导致,哪怕每一部合格率都有99%,最终良率都会在0.9×0.9的多次累积下,趋近于0。这也是荷兰ASML的EVU芯片光刻机价值不菲的原因。
那对于荧光定量PCR实验,各环节细微的问题会被指数扩增予以放大,引起定量结果的不准确。我们来看下,小翌收集到的核酸质量对于结果影响的案例。
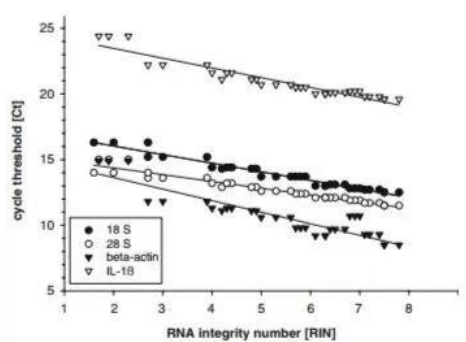
小翌检索到一篇关于RNA质量度对于定量结果的影响评价的一篇文章。文章作者制备了降解程度不同的RNA模板,模板质量的评价采用的是当前最先进的Aligent 2100仪器,将RNA的质量划分为1-10个等级,用RIN值(RNA Integrity Number,即RNA完整度)表示,RIN值越接近于10,质量越佳。之后,进行定量实验来评价模板质量对于高、低丰度不同的几个代表性基因的影响。研究表明:降解的RNA,样本间重复性波动极大,越来越偏离真实的定量结果!
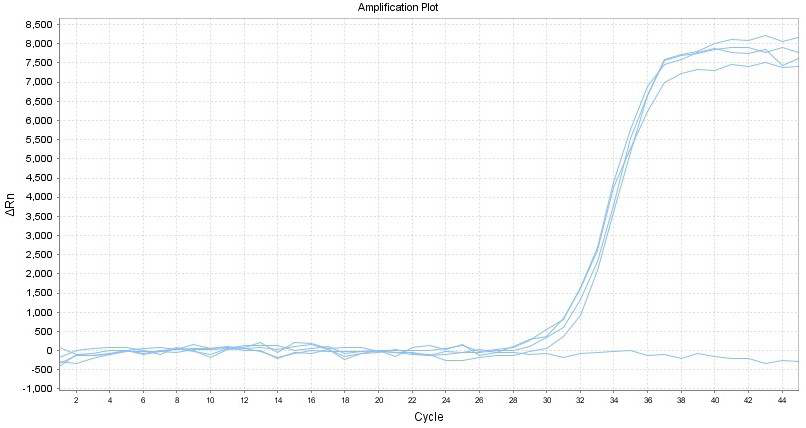
小翌处理过这样的案子:荧光定量PCR扩增曲线平台期呈不规则的锯齿波浪线(见下图)。这类结果严重偏离了规则的“S”型扩增曲线,平台期不平稳,但能拿到Ct值。通过排除一系列因素,察觉到是RNA加入量过高,但RNA纯度不够,导致抑制剂含量增加,平台期出现信号不稳,出现波动!由于存在抑制剂,这类数据干扰了扩增效率,使定量数据不可用!
也有人反馈自己的PCR结果不理想,换酶换程序换引物都不能解决问题,却完全忽略了“gDNA质量”这一关键环节。
看似谁都会做的核酸提取,其实是实验小白的一座不易逾越的大山!较先进和科学的、可对核酸质量评级的RIN值、DIN值类的方法更多局限于工业化实验室使用,且核酸用途广泛,核酸质量对每个分支应用的影响也缺乏系统性的解读。核酸提取实验成为了重过程、轻结果的一个实验,实属不得已而为之。较科学的结果评判标准及核酸质量对于实验结果的影响,至今均未系统化的有过普及。下面我们以较为常见的OD值评测方法,进行介绍,欢迎大家补充。
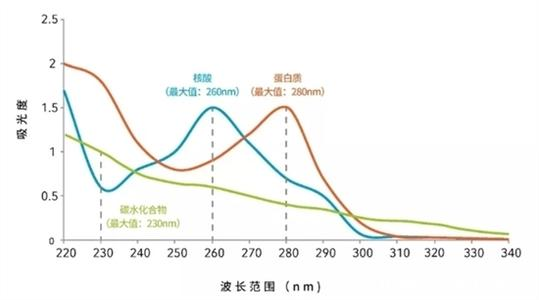
吸光度值测定方法是通过评测不同被检测物在特定波长光谱下的吸光度。不同的纯粹物质,在不同波长下具有吸光度。理论上来看,越纯粹的物质,吸光度值越单一,是有理可循的。因此,可将单一纯粹性的标准品测定得到的读值为标准来评测模板质量。
核酸的嘌呤环和嘧啶环有共轭双键,在260 nm处有最大吸收峰。蛋白质和酚类常含有苯环结构,在280 nm处有最大吸收峰。碳水化合物、盐类、有机溶剂等在230 nm处有最大吸收峰。即OD260、OD280、OD230分别代表核酸、蛋白/酚、有机污染物的吸光度(见下图)。
以纯DNA为样品,测定得到的OD260/OD280≈1.8,一般在1.7-1.9之间,OD260/OD230>2.0
以纯RNA为样品,测定得到的OD260/OD280≈2.0,一般在1.9-2.1之间,OD260/OD230>2.0
OD260/280比值会受测定所用溶液的pH值的影响,例如,溶解RNA在pH=8.5的10 mM Tris缓冲液中OD260/280读数在1.9-2.1之间,而在中性的水溶液中比值会变低,可能只有1.8-2.0。
RNA比DNA紫外吸收高的原因是RNA是单链,碱基(共轭双键)得以暴露,紫外吸收峰高,而DNA是双链螺旋结构,碱基互补配对使得共轭双键隐藏在内,碱基堆积力“束缚”对紫外线的吸收,所以紫外吸收峰较低。所以,纯RNA的OD260/OD280比纯DNA要大。
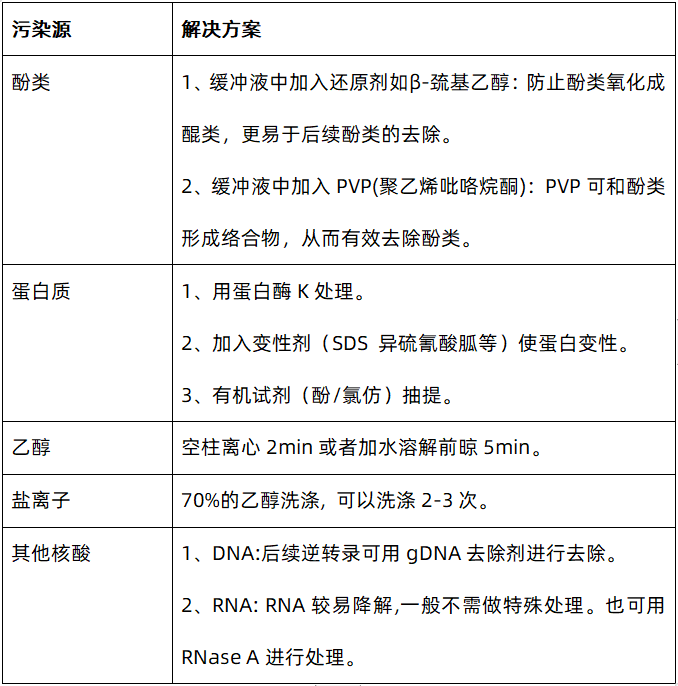
若OD260/OD280>1.9:表明有RNA污染或部分DNA降解成寡聚核苷酸或单核苷酸(dNTPs),寡聚核苷酸或dNTPs会提高OD260的值,从而造成OD260/OD280偏高,当OD260/OD280>2.2,DNA基本上已完全降解。
若OD260/OD280<1.6:有可能有蛋白质残留,氨基酸残基中的苯环在280nm处有吸收从而造成比值偏低,当然也有可能是其他苯环物质(酚类)造成的。
若OD260/OD230<2.0:可能是由于乙醇、碳水化合物等在230nm处有吸收,从而导致比值偏低。
若OD260/OD280<1.7:表明在280nm处蛋白质或酚类有吸收峰,从而造成值偏低。
若OD260/OD280>2.0:可能由于RNA的降解,造成260nm处的吸收增强,从而导致比值偏高。
若OD260/OD230<2.0: 可能是在230nm处,残留的异硫氰酸胍、β-巯基乙醇、乙醇等有吸收,从而造成比值偏低。
模板质量评价,谈何容易!通常,我们还要用通过琼脂糖凝胶电泳对核酸进行进一步评估。
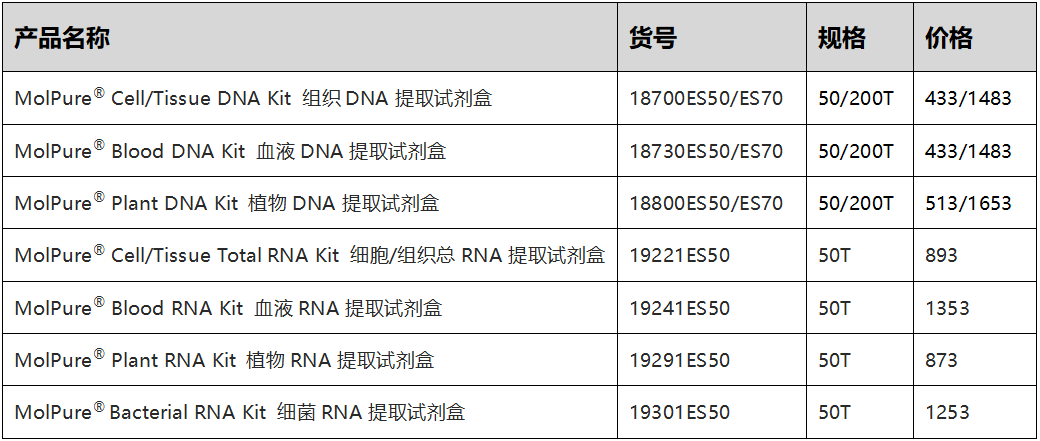
小翌家通过采用独特的离心柱及精心优化的缓冲体系有效捕获释放的核酸,提取的DNA或RNA纯度高,质量稳定可靠,适用于各种下游应用实验,如PCR、荧光定量PCR等实验!
HB200813