大家好,我是你们的实验小助手小翌,上一期我们讲到了细胞凋亡检测的各种手段。这一期我们主要讲TUNEL检测细胞凋亡实验——分析实验中TUNEL染色结果失败的原因。首先要先了解一下TUNEL染色步骤,如下图所示。
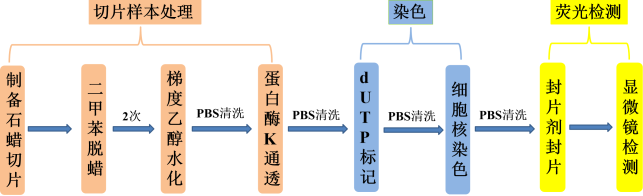
图1. TUNEL染色操作步骤(注:细胞核染色步骤可选)
用TUNEL试剂盒检测细胞凋亡过程中,需要用到蛋白酶K、荧光素-dUTP、TdT酶等各种试剂。除此以外,还要设置阳性和阴性对照组,面对染色步骤繁琐,许多人表示疑惑,下面我们就一一解答。
01
TUNEL试剂盒主要成分及功能
1)Equilibration缓冲液:用于维持一定的反应条件,缓冲液中的Mg2+降低背景,Mn2+增强染色效果。
2)蛋白酶K(Proteinase K):通透细胞膜和核膜,保证TUNEL探针进入细胞中,保证染色充分。
3)荧光素-dUTP:标记3'-OH末端和作为TdT酶的底物。
4)TdT酶:催化dUTP标记3'-OH末端的关键酶。
02
阳性组、阴性组、实验组
1)阳性组:用DNase酶处理,诱导细胞凋亡、暴露出3'-OH末端。每次实验做一个即可。
2)阴性组:不加TdT酶,其余操作和实验组相同。每种切片样本各需要做一个阴性对照。比如有5个老鼠的肺组织切片样本,那么就需要做5个阴性组。
3)实验组:除了阳性组和阴性组,所有的样本均是实验组。
03
为什么设置阳性组、阴性组
1)阳性组:用来验证本次实验操作和试剂盒有无问题。
2)阴性组:a.排除细胞自身凋亡以及操作过程等原因导致的非特异性染色;b.调整拍摄曝光强度。
除此以外,大家或多或少会遇到染色结果异常,包括荧光信号弱、没有荧光信号、假阳性高、荧光背景强等问题。染色失败的原因主要包括样本处理不当、染色不充分、曝光时间过长等,可从以下几个方面对症分析。
04
荧光信号弱或没有荧光信号
若已知细胞或者组织样本处于细胞凋亡状态,但是用TUNEL试剂盒检测发现荧光信号偏弱或没有信号。
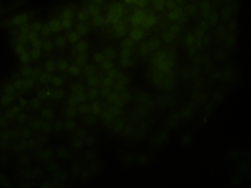
4.1 样本处理不当
1)样本切片太厚。建议适当将切片切薄一点,便于染色。
2)脱蜡和水化不充分。建议脱蜡先60 ºC 20 min,再使用二甲苯两次5-10 min;而水化用梯度乙醇从高到低浓度浸洗。
3)Proteinase K的孵育时间过短。优化Proteinase K的孵育时间,常用时间10-30 min。4 μm左右的片子孵育10 min,30μm左右的片子孵育30 min。
4)Proteinase K浓度过低。建议蛋白酶K一般工作液浓度为20 μg/mL。
5)放置在-20 ºC保存较长时间的切片不新鲜,减低染色效率。建议使用新鲜切片。
4.2 染色操作不当
6)染色时间过短。建议一般 37 ºC 孵育60 min,可以根据凋亡损伤程度,可长至2 h,但要结合背景着色。
7)TdT酶或荧光素/酶标记的dUTP浓度过低。建议适当提高TdT酶或荧光素/酶标记的dUTP浓度。
8)TdT酶失活。建议TUNEL反应液临用前配制,短时间在冰上保存。不宜长期保存,长期保存会导致TdT酶失活。
9)样本干燥。加上TUNEL反应液后,请盖上盖玻片/保鲜膜/湿盒中进行,保证样本均匀染色,又可防止反应液干燥。
4.3 荧光检测操作不当
10)操作未避光。由于荧光易碎灭,建议标记与检测样本时,载玻片要避光,观察时要尽量快。
05
非特异性染色(假阳性高)
若已知细胞或者组织样本依然处于活细胞状态,但是用TUNEL试剂盒检测,出现了非特异性染色,和处理过的荧光信号一样强,甚至比阳性对照组荧光信号还要强。
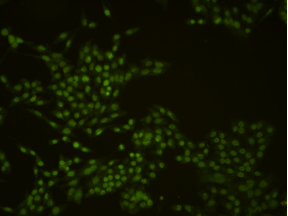
5.1 样本处理不当
1)使用酸性或碱性固定液,导致DNA损伤。建议使用pH中性的固定液固定组织或者细胞。
2)固定液浓度过高,导致细胞自溶、DNA链不规则断裂、造成假阳性。建议使用4%多聚甲醛溶液(溶于PBS)。
3)固定时间过长,导致细胞自溶、DNA链不规则断裂、造成假阳性。建议控制固定时间在4 ℃放置25 min。
4)蛋白酶K处理时间过长,破坏核酸结构,出现假阳性。建议适当缩短处理时间。
5)蛋白酶K浓度过大,破坏核酸结构,出现假阳性。建议适当调整蛋白酶 K溶液浓度,一般工作液浓度为20 μg/mL。
5.2 染色操作不当
6)TUNEL染色时间过长。建议一般是 37 ºC 孵育60 min,可以根据凋亡损伤程度,可长至2 h,但要结合背景着色。
7)未充分清洗样本。染色后PBS清洗次数可增加到5次,来避免切片的非特异性染色。
06
荧光背景强
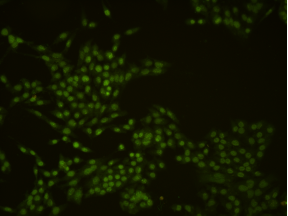
6.1 染色操作不当
1)TUNEL染色时间过长。建议染色时间适当,一般是 37 ºC 孵育60 min,避免串色。
2)TUNEL染色液浓度过大。建议增大稀释倍数,优化浓度。
3) 使用试剂盒提供的二价阳离子优化反应,试剂盒中的Mg2+可降低背景,Mn2+可增强染色效果。
4)PBS未充分清洗样本。在TUNEL反应后PBS清洗次数可增加到5次,来避免切片样本中残留的染料。
6.2 荧光检测操作不当
5)曝光时间过长。建议调整曝光条件,先对阴性组调整到无背景光,然后用这个曝光条件去拍摄实验组(可以微调,但是不需要大调)。

欢迎大家留言!
