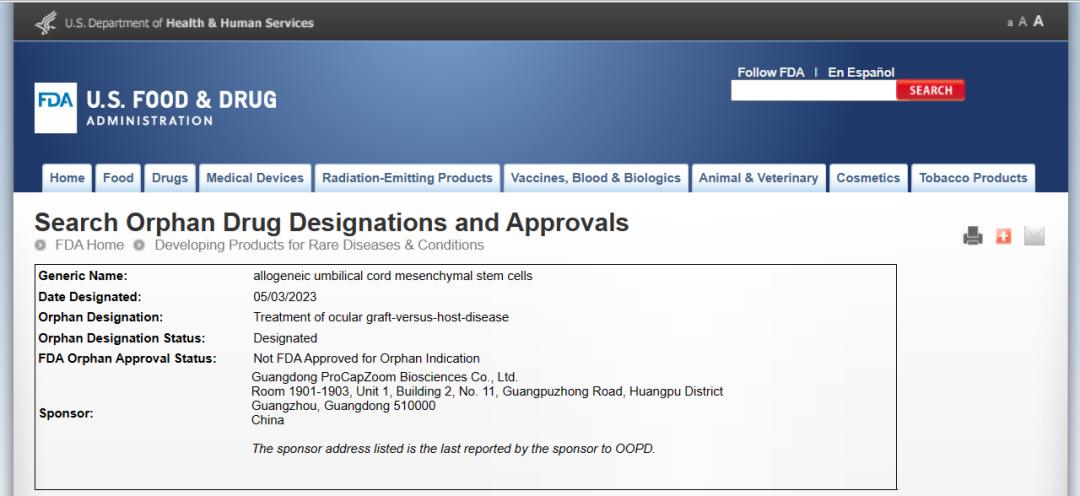
5月3日,翌圣生物重要战略合作伙伴——广东普罗凯融生物医药科技有限公司(简称“普罗凯融”)收到美国食品药品监督管理局(FDA)孤儿药开发办公室(Office of Orphan Products Development, OOPD)的函件,通知其自主开发的MSCohi-O®获FDA颁发孤儿药资格认定。
MSCohi-O®主要用于治疗眼部移植物抗宿主病(oGVHD)。MSCohi-O®是全球第一款针对治疗眼部移植物抗宿主病被FDA认定孤儿药的药物。
翌圣生物在此项目中提供了全面的支原体NAT快速检测相关的技术服务与验证支持,其中MycAwayTM支原体qPCR检测试剂盒已根据EP 2.6.7和JP G3对其专属性、检测限和耐用性进行了全面验证,同时覆盖USP、WHO、ChP等中要求验证的支原体菌株类型,试剂盒性能符合中外法规及国际权威机构标准,助力该项目顺利获得FDA孤儿药资格认定。
目前,翌圣生物支原体快速检测产品已助力国内多个IND成功申报和待申报项目,本次助力普罗凯融MSCohi-O®获得FDA孤儿药资格认定,是对翌圣生物支原体检测系列产品与服务的高度认可,对翌圣产品拓展海外市场也具有重要的意义。
MSCohi-O®是普罗凯融全球独创的负载间充质干细胞的高透氧水凝胶镜片,具有完全自主知识产权的原创产品,已提交中美发明专利保护,并获中国发明专利授权。其核心创新性是解决脐带间充质干细胞自身无法停留在眼表的瓶颈障碍,实现稳定的眼表局部给药,从机理上治疗免疫相关的眼科疾病。截止目前,全球尚无同类型的产品研发上市,极具创新性。
此次,FDA孤儿药资格的认定是MSCohi-O®产品在开发过程中的重要里程碑,对于加速推动MSCohi-O®在中美的临床开发以及今后注册上市起到积极作用。
广东普罗凯融生物医药科技有限公司是一家专注于细胞治疗产品研发,致力于恶性肿瘤、心血管、视觉等重大疑难疾病的精准细胞治疗和药物研发的国家高新技术企业。公司建立了干细胞技术研发平台和免疫细胞技术研发两大创新型技术平台,以及具备成熟的工艺开发及质量控制。公司拥有国家发明专利技术四十余项,已通过GMP认证、CNAS认证、美国NEBB认证、iSO管理体系认证等体系认证,并且是全球药理安全HESI/CiPA协会的唯二中国成员(另一成员是国家药品监督管理局的直属事业单位中国食品药品检定研究院)。