DNA片段大小风险等级划分
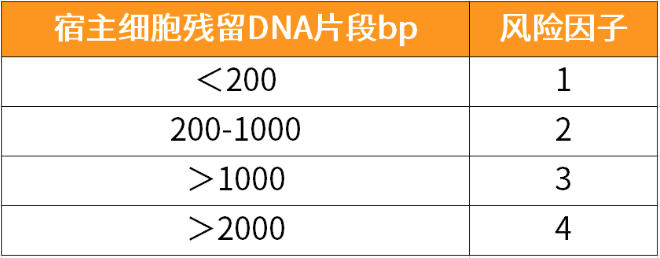
注:风险程度依据风险等级递增


目前,检测宿主细胞残留DNA含量的方法都相对成熟,而且药典法规也有明确规定,如《中华人民共和国药典》2020年版第三部规定,外源性DNA残留检测采用DNA探针杂交法、荧光染料色法和定量PCR法
然而,关于残留DNA片段大小的检测与分析,目前还没有特定推荐的方法。
目前,行业内对于残留宿主细胞DNA片段分析,主要是利用毛细管电泳的方法。研究者们开发了一种基于毛细管凝胶电泳与敏感激光诱导荧光(CGE-LIF)检测残留DNA分子大小的方法,可以检测生物制品中残留DNA的大小,实验表明,大多数宿主细胞残留DNA片段大小为50-2000bp。除了毛细管电泳法外,实时荧光定量PCR(qPCR)法也被用于进行生物制品中生产用细胞相关的DNA片段分布的分析。且qPCR法相比于CGE-LIF操作更简单,耗时更短。
针对上述情况,翌圣生物自主研发了HEK293残留DNA片段分析试剂盒,采用荧光探针qPCR法原理,设计了四种不同的扩增片段(82bp、133bp、227bp、515bp),用于定量检测样本中HEK293宿主细胞残留DNA片段的大小分布情况。样本类型包括:慢病毒上清液、腺相关病毒AAV上清液、HEK293细胞裂解液等。还研发了与之配套使用的宿主细胞残留DNA样本前处理试剂盒,以及配套的自动化核酸提取仪器。
HEK293残留DNA片段分析Kit产品性能
产品信息
|
产品 |
货号 |
品名 |
规格 |
|
样本前处理试剂盒 |
18461ES |
MolPure® Magnetic Residual DNA Sample Preparation Kit磁珠法残留DNA样本前处理试剂盒(瓶装) |
25T/100T |
|
18462ES |
MolPure® Mag32 Residual DNA Sample Preparation Kit FA磁珠法残留DNA样本前处理试剂盒FA(预封装) |
2×16T/6×16T |
|
|
核酸提取仪器 |
80501ES |
Auto-Pure 32A automated nucleic acid extraction system Auto-Pure 32A全自动核酸提取仪 |
32通量 |
|
残留DNA片段分析试剂盒 |
41316ES |
HEK293 Host Cell Residue DNA Size Analysis Kit HEK293 宿主细胞残留 DNA 片段分析试剂盒 |
4×50T/4×100T |
参考文献
