Vero宿主残留DNA检测试剂盒——助力疫苗产品研发
疫苗是将病原微生物(如细菌、立克次氏体、病毒等)及其代谢产物,经过人工减毒、灭活或利用转基因等方法制成的用于预防传染病的自动免疫生物制剂。疫苗的发现极大程度保护了人类健康,使人类在面对传染病威胁时,化被动为主动,在降低死亡率和提高人均预期寿命方面发挥了不可替代的作用。
自12世纪中国开始用人痘接种来预防天花以来,至18世纪英国出现牛痘接种预防天花止,疫苗终于成为免疫手法进入人类医学界。
目前用于人类疾病防治的疫苗有20多种,在此期间,疫苗经历了第一代的传统疫苗、第二代重组基因工程疫苗及第三代核酸疫苗的发展,并已出现了以治疗为目的的治疗性疫苗。
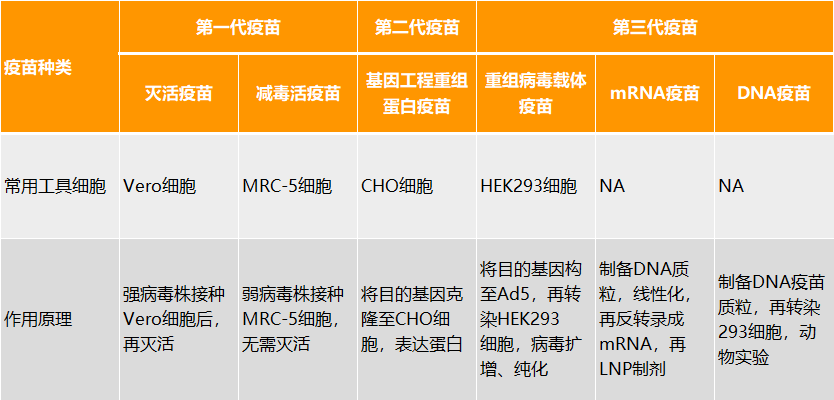
常见疫苗类型及作用机制
从流感减毒活疫苗到灭活全病毒疫苗的发展,Vero细胞都发挥了重要的价值。Vero细胞被WHO和我国药品监督管理局认可,用于生物制品生产的传代细胞。
它是一种理想的疫苗,生产基质:遗传背景清楚,核型稳定,无外源因子污染,160代以内没有致瘤性,适合大规模培养,可用生物反应器生产,保证了疫苗大批量细胞的均质性和安全性。但是,疫苗中Vero宿主细胞残留DNA也受药品监管部门管控。
由于外源宿主细胞残留DNA会引发潜在的安全问题(如潜在致瘤性、传染性,甚至增加免疫源性或导致突变),所以相关的法律法规相继出台,以对生物制品中外源宿主DNA残留量进行严格把控。
WHO和美国FDA现行指导方针推荐成品中残留DNA不高于10ng/剂,美国FDA还指出生物制品宿主细胞DNA残留量≤100pg/剂。《中华人民共和国药典》2020年版第三部也规定,冻干乙型脑炎灭活疫苗(Vero细胞)DNA残留量应不高于100pg/剂,Sabin株脊髓灰质炎灭活疫苗(Vero细胞)DNA残留量应不高于50pg/剂。
现行各国药典中生物制品残留DNA检测方法主要有4种:杂交法、阈值法、荧光染料法和定量PCR法等。其中,qPCR法具有极高的灵敏度、序列特异性和准确性,可为生物制药工业在工艺研究和成品质量控制方面提供可靠的检测手段,现也已成为各生物制品厂家首选检测方法。
针对上述情况,翌圣生物自主研发了Vero残留DNA检测试剂盒,其能专一快速的检测利用Vero细胞生产的疫苗等生物制品中DNA 残留量。还研发了与之配套使用的宿主细胞残留 DNA 样本前处理试剂盒,以及配套的自动化核酸提取仪器。
下图就宿主细胞残留DNA检测工作流程,进行了详细介绍:
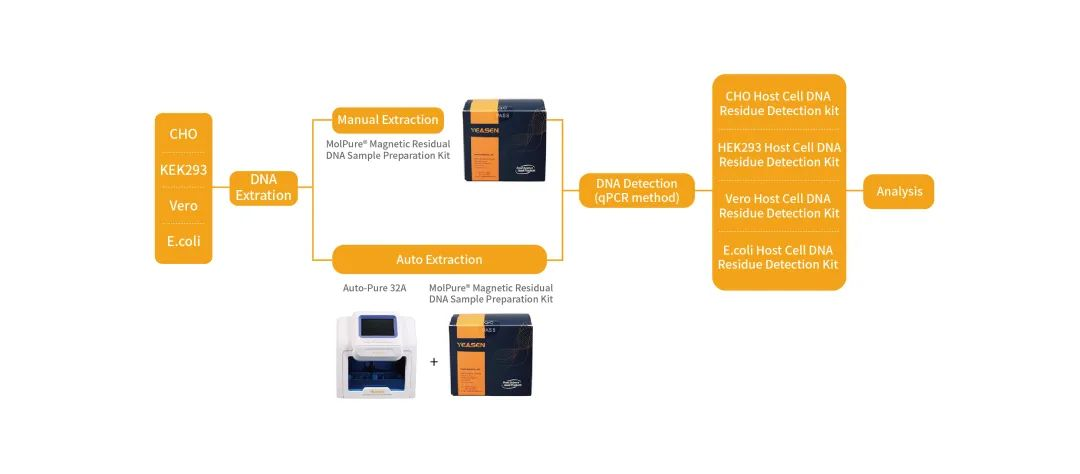
宿主细胞残留DNA检测实验流程
Vero残留DNA检测Kit产品性能:
符合法规:按照法规要求进行全面验证,可提供验证报告;
灵敏度高:定量限可达0.3fg/μL;
准确性高:DNA参考品与国家标准物质标曲基本无偏差,检测值CV<5%;
精密度高:重复性CV值<10%,中间精密度<15%;
专属性强:不同细胞系间无交叉反应;
定量准确:配套专属磁珠法样本前处理试剂盒;
操作便捷:简单快速,可自动化前处理,只需6小时完成样本处理和qPCR检测。
产品信息:
|
|
货号 |
名称 |
|
|
|
18461ES |
MolPure® Magnetic Residual DNA Sample Preparation Kit磁珠法残留DNA样本前处理试剂盒(瓶装) |
|
|
18462ES |
MolPure® Mag32 Residual DNA Sample Preparation Kit FA磁珠法残留DNA样本前处理试剂盒FA(预封装) |
|
|
|
|
80501ES |
Auto-Pure 32A automated nucleic acid extraction system Auto-Pure 32A全自动核酸提取仪 |
|
|
|
41332ES |
CHO Host Cell DNA Residue Detection Kit (3G)CHO宿主细胞DNA残留检测试剂盒 (3G) |
|
|
41331ES |
HEK293 Host Cell DNA Residue Detection Kit(3G)HEK293宿主细胞残留DNA检测试剂盒(3G) |
|
|
|
41307ES |
Vero Host Cell DNA Residue Detection Kit(2G)Vero宿主细胞DNA残留检测试剂盒(2G) |
|
|
|
41308ES |
E.coli Host Cell DNA Residue Detection Kit (2G)E.coli 宿主细胞DNA残留检测试剂盒(2G) |
|
|
点击产品名称了解详情
