体外细胞转染试剂产品选择指南
转染的类型
细胞转染试剂已经成为研究和控制真核细胞基因功能的常规试剂,转染试剂在基因功能研究、基因表达调控、突变分析,以及基因治疗、细胞治疗、蛋白生产、疫苗生产等方面应用广泛。
根据转染后核酸是否整合到宿主细胞染色体中分成“瞬转”(瞬时转染)和“稳转”(稳定转染)。不同转染方法的转染效率、细胞毒性、对正常生理学的影响和基因表达水平各不相同,其原理、应用与特点比较如下表所示:
表1 不同转染方法的比较
|
技术 |
原理 |
优点 |
缺点 |
|
化学转染方法 |
|||
|
阳离子脂质体 |
带正电的脂质体与核酸带负电的磷酸基团形成复合物被细胞内吞。 |
操作快速简单 结果可重复 转染效率高 可转染DNA,RNA和蛋白质 适用于生产瞬时和稳定的蛋白质 可用于体内转染 |
需进行条件优化(一些细胞系对阳离子脂质体较敏感) 有些细胞系不容易转染 血清的存在干扰复合物的形成,导致低转染效率 培养基中血清的缺失会增加细胞毒性 |
|
磷酸钙共沉淀 |
磷酸钙DNA复合物吸附细胞膜被细胞内吞 |
便宜且容易获得 适用于生产瞬时和稳定的蛋白质 转染效率高(不限制细胞系) |
需要仔细制备试剂 – CaPO4溶液对pH,温度和缓冲盐浓度的变化敏感 可重复性较差 有细胞毒性,尤其对原代细胞 不能采用RPMI培养基,由于其含高浓度的磷酸盐 不适用于动物体内转染 |
|
葡聚糖 |
带正电的DEAE-右旋糖苷与核酸带负电的磷酸骨架相互作用形成的复合物被细胞内吞。 |
操作简单 结果可重复 便宜 |
对某些细胞有化学毒性 只限于瞬时转染 转染效率低,尤其在原代细胞中 |
|
其他阳离子聚合物 |
带正电的聚合物与核酸带负电的磷酸基团形成带正电的复合物后与细胞表面带负电的蛋白多糖相互作用,并通过内吞作用进入细胞。 |
在血清中稳定,对温度不敏感 高转染效率(限制细胞系) 结果可重复 |
对某些细胞有毒性 不能生物降解(树枝状大分子) 多用于瞬时转染,较少用于稳定转染 |
|
生物转染方法 |
|||
|
病毒转染 |
本能感染细胞,传递遗传物质 |
高转染效率 适用于较难转染的细胞系 可用于体内转染 可用于构建稳定表达或瞬时表达的细胞系 |
被转染的细胞系必须含有病毒受体 基因插入大小受限(病毒载体~10 kb,非病毒载体~100 kb) 技术难度高,且构建重组蛋白很费时 存在生物安全问题(激活潜在疾病,免疫原性反应,细胞毒性,插入突变,使细胞恶性转化) |
|
物理转染方法 |
|||
|
电转 |
高脉冲电压破坏细胞膜电位,DNA通过膜上形成的小孔导入。 |
原理简单 条件优化后可产生重复性的结果 不需要载体 不限制细胞类型和条件 条件优化后可以快速转染大量细胞 |
需要特殊的设备 需要优化电转脉冲和电压参数 对细胞伤害很大 细胞死亡率很高因此需要大量细胞 会不可逆转地损坏细胞膜,溶解细胞 |
|
生物传递粒子传递(粒子轰击) |
将DNA用显微重金属颗粒沉淀,再将包被好的颗粒用弹道装置投射入细胞,DNA在胞内逐步释放表达。 |
不限制细胞类型和条件 可用于动物体内转染 方法直接,结果可靠 不限制导入基因的大小和数量 |
需要昂贵的设备 会对样品产生物理损伤 细胞死亡率很高因此需要大量细胞 需要准备微粒 转染效率相对较低 对于研究应用成本较昂贵 |
|
显微注射 |
用显微操作将DNA直接注入靶细胞核。 |
不限制细胞类型和条件 可以单细胞转染 方法直接,结果可靠 不限制导入基因的大小和数量 不需要载体 |
需要昂贵的设备 有技术要求,且是劳动密集型(一次只能转染一个细胞) 转染细胞数有限 常引起细胞死亡 |
产品特点
针对DNA转染试剂与RNA转染试剂,翌圣生物拥有雄厚的研发与生产团队,不断优化配方,改良生产工艺,推出了多款以阳离子脂质体与阳离子聚合物为基础的产品,为广大科研院校与企业提供全方位的产品,产品线覆盖转染试剂涉及的各个领域。
|
40802ES |
40803ES |
40804ES |
40805ES |
|
Hieff Trans™ Universal Transfection Reagent Hieff Trans™通用型转染试剂
|
Polyethylenimine Linear(PEI) MW40000(rapid lysis) 线性PEI转染试剂(速溶型)MW40000 |
||
|
40806ES |
40808ES |
40815ES |
40816ES |
高效性:适合瞬时转染或者稳定转染细胞系。
低毒性:转染的细胞仍保持很好的活性。
适应性广:普通细胞、难转染的原代细胞全面覆盖。
操作简便:适合血清存在的培养基,转染前后无需更换培养基。
性价比高:经济实用,转染效率高,价格低。
选择指南
转染试剂的选择,需要根据实验目的与实验内容的不同进行选择,如转染的物质、具体的细胞、操作的便捷性等因素综合考量。
|
产品 |
Hieff Trans™ Universal Transfection Reagent Hieff Trans™通用型转染试剂 |
Polyethylenimine Linear(PEI) MW40000(rapid lysis) 线性PEI转染试剂(速溶型)MW40000 |
|||||
|
细胞类型 |
常规 |
常规 |
常规 |
常规 |
常规 |
常规 |
常规 |
|
难转染 |
难转染 |
|
|
||||
|
核酸类型 |
DNA |
DNA |
DNA |
DNA |
DNA |
DNA |
|
|
siRNA |
siRNA |
siRNA |
siRNA |
||||
|
miRNA |
miRNA |
||||||
|
mimic miRNA |
mimic miRNA |
||||||
|
antimiRNA |
antimiRNA |
||||||
|
DNA/siRNA共转染 |
DNA/siRNA共转染 |
DNA/siRNA共转染 |
|||||
|
多质粒病毒包装 |
多质粒病毒包装 |
多质粒病毒包装 |
多质粒病毒包装 |
多质粒病毒包装 |
应用案例
Hieff Trans™ Liposomal Transfection Reagent 脂质体核酸转染试剂
Hieff TransTM以无菌的液体形式提供。通常情况下对于24孔板转染,每次用1.5 μL左右,则1 mL Hieff TransTM约可做660次转染;对于6孔板,每次用6 μL左右,则1 mL Hieff TransTM约可做160次转染;
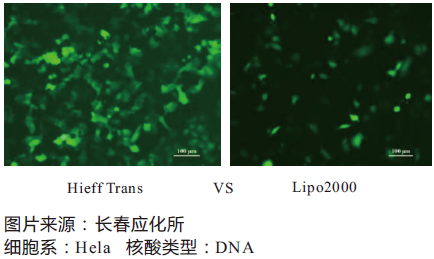
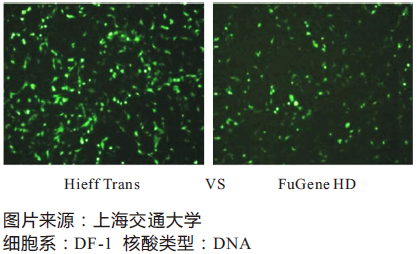
更多详情请参见Hieff Trans™脂质体转染试剂,让您对转染自信满满
Polyethylenimine Linear (PEI) MW40000(rapid lysis) 线性PEI转染试剂(速溶型)MW40000
PEI 40000是一种分子量为40000的高电荷阳离子聚合物,非常容易结合带负电荷的核酸分子,形成复合物,并使该复合物进入细胞中。PEI 40000是一种瞬时转染试剂,细胞毒性低,转染效率高,在HEK293和CHO等细胞中基因表达效率较高。目前已经验证线性PEI转染试剂广泛适用于多种细胞系包括HEK-293、HEK293T、CHO-K1、COS-1、COS-7、NIH/3T3 、Sf9、HepG2和Hela细胞等。转染效率高达80%~90%。
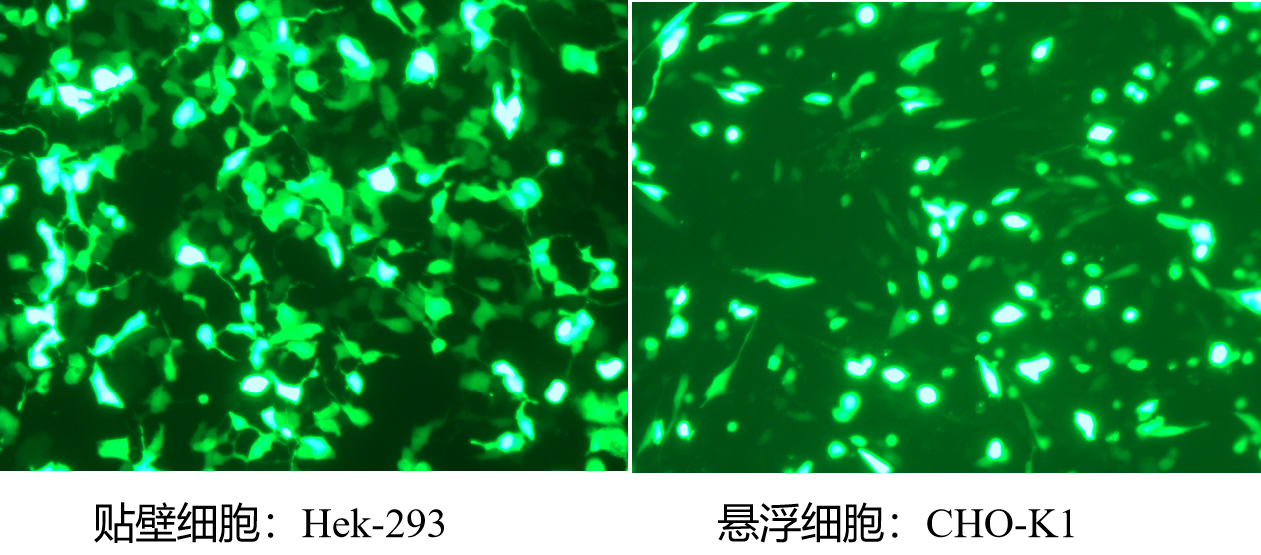
更多详情请参见转染新宠——PEI MAX (线性PEI MW 40000)更高效的转染试剂
Hieff Trans™ siRNA/miRNA体外转染试剂
该产品可在广泛的细胞系中,实现1 nM的siRNA超过90%的表达效率,避免了脱靶效应。适用于多种细胞转染,包括Hela、MCF-7、HepG2、CHO等贴壁细胞;以及难以转染的悬浮细胞系,如K562或THP-1细胞,可达到80%的沉默效率;同时还包括一些原代细胞,原代人成纤维细胞和原代人肝细胞等,可达到80%的沉默效率。
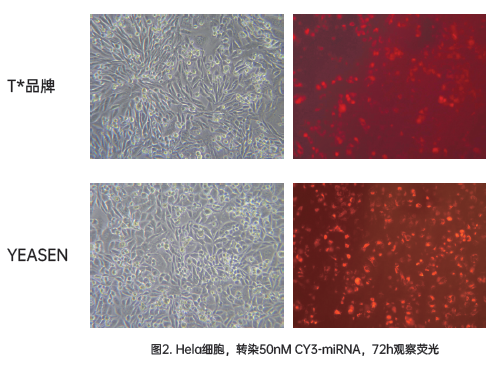
转染条件参考
除各产品的说明书外,客户根据各自具体的实验内容进行操作,在使用量上会有不同的差异,根据客户使用产品后反馈的体外细胞转染条件,进行了整理,供大家参考。
|
产品名称/货号 |
Hieff Trans™ Liposomal Transfection Reagent 脂质体核酸转染试剂/40802ES |
||||
|
细胞 |
培养容器 |
铺板密度 |
DNA量 |
Hieff trans量 |
转染效率 |
|
A549 |
6 well |
90% |
0.7 μg |
1.15 μL |
+++ |
|
BV 2 |
24 well |
95% |
0.2 μg |
0.2 μL |
++ |
|
C2C12 |
24 well |
80% - 90% |
1 μg |
5 μL |
++ |
|
DF 1 |
24 well |
80% - 90% |
0.5 μg |
0.5 μL |
+++ |
|
H520 |
6 well |
80% |
1.2μg |
6 μL |
++ |
|
HaCaT |
96 well |
70% |
100 ng |
1 μL |
++ |
|
HCT116 |
6 well |
90% |
4 μg |
10 μL |
++ |
|
HEK 293 |
6 well |
95% |
2 μg |
10 μL |
80 - 90% |
|
HEK 293FT |
24 well |
85% |
1 μg |
4 μL |
90% |
|
HEK 293T |
12 well |
1×105 |
1 μg |
2 μL |
+++ |
|
HEK 293T(悬浮) |
30 ml |
80% |
30 μg |
60 μL |
++ |
|
Hela |
12 well |
90% |
0.2μg |
0.6 μL |
90% |
|
Hela |
12 well |
80% |
1 μg |
3 μL |
+++ |
|
HepG2 |
12 well |
80% |
1 μg |
3 μL |
++ |
|
HUVEC |
24 well |
80% |
1 μg |
2 μL |
++ |
|
MCF10A |
10 cm dish |
60% |
5 μg |
15 μL |
++ |
|
N2A |
24 well |
70% - 80% |
300 ng |
900 μL |
+ |
|
NCI H1975 |
6 well |
80% |
4 μg |
10 μL |
+++ |
|
NIH 3T3 |
6 well |
90% |
4 μg |
10 μL |
+++ |
|
Raw 264.7 |
35 mm dish |
80% |
1 μg |
2 μL |
90% |
|
Vero |
6 well |
80% |
3 μg |
9 μL |
+++ |
|
细胞 |
培养容器 |
铺板密度 |
siRNA量 |
Hieff trans量 |
转染效率 |
|
HK2 |
6 well |
65% |
100 pmol |
6 μL |
+++ |
常见问题
一 Hieff Trans™ Liposomal Transfection Reagent 脂质体核酸转染试剂
Q: 配制核酸转染试剂复合物时能否有血清的存在?
A: 血清的存在会影响脂质体的形成,建议配制核酸转染试剂复合物时采用无血清培养基(一般推荐MEM 培养基)。
Q: 使用Hieff Trans™脂质体核酸转染试剂需要注意什么?
A:
1)细胞转染时,细胞密度以80%-95%为佳,具体铺板密度根据细胞情况酌情而定;
2)使用高纯度的DNA有助于获得较高的转染效率;
3)制备转染复合物时要求用无血清培养基稀释DNA和转染试剂;
4)转染的时候培养基中不能添加抗生素;
5)试剂应该在2-8℃度保存,要注意避免多次反复长时间开盖;
6)初次使用应优化DNA浓度和阳离子脂质体试剂量以得到最大的转染效率。DNA 和转染试剂的比例,通常推荐是1:2-1:3。
Q:转染后需要进行终止吗?
A:不需要。脂质体复合物可以稳定存在6个小时。如果在进行转染前没有进行细胞换液,为了保证细胞正常生长所需的营养,需要在4~6小时后换用新的培养基。但如果转染之前已进行过换液,则在脂质体转染后不需要进行再次换液。
Q:可否进行DNA和siRNA的共转染?效果如何?
A:可以,DNA和siRNA的共转染时候,siRNA转染效率会略微差点。
Q:转染试剂可否进行慢病毒包装的转染呢?
A:慢病毒包装是可以的。
Q:悬浮细胞转染是否可以用Hieff Trans™脂质体核酸转染试剂?
A:Hieff Trans™脂质体核酸转染试剂可以用于悬浮细胞转染,具体操作可见Protocol。另外,我们还推出了专门用于悬浮细胞的转染试剂(Cat No. 40805, 悬浮细胞专用脂质体核酸转染试剂)。
二 Hieff Trans™ siRNA/miRNA体外转染试剂
Q: 转染试剂转染后需要换液吗?
A: 对于换液,可以区分两种情况;1、转染之前如果没有换液,应在转染6 小时左右后换液,以保证细胞生长所需营养,2、如果转染之前有换液,可以按照平时等到培养基出现营养不足时换液。
Q:转染试剂可以冻存吗?
A:不可冻存,因为转染试剂是一种PEI阳离子转染试剂,低温下冻存,会破坏PEI转染试剂的活性,因此最好是2-8℃度储存,保持最好的转染效能。
产品订购
|
应用场景 |
名称 |
货号 |
规格 |
|
细胞类型:贴壁/悬浮 核酸类型:DNA、siRNA |
40802ES02 |
0.5 mL |
|
|
40802ES03 |
1.0 mL |
||
|
40802ES08 |
5×1 mL |
||
|
细胞类型:贴壁/悬浮 |
40803ES70 |
200 T |
|
|
用途:病毒感染、DNA转染 |
40804ES76 |
500 μL |
|
|
40804ES86 |
5×500 μL |
||
|
细胞类型:悬浮 |
40805ES02 |
0.5 mL |
|
|
40805ES03 |
1.0 mL |
||
|
40805ES08 |
5×1 mL |
||
|
细胞类型:贴壁/悬浮 |
40806ES01 |
0.1 mL |
|
|
40806ES02 |
0.5 mL |
||
|
40806ES03 |
1.0 mL |
||
|
细胞类型:贴壁/悬浮 |
40808ES02 |
0.5 mL |
|
|
40808ES03 |
1 mL |
||
|
40808ES08 |
5×1 mL |
||
|
细胞类型:贴壁/悬浮 |
40809ES01 |
0.1 mL |
|
|
40809ES03 |
1 mL |
||
|
细胞类型:贴壁/悬浮 |
40815ES03 |
1 g |
|
|
40815ES08 |
5×1 g |
||
|
细胞类型:贴壁/悬浮 |
40816ES02 |
100 mg |
|
|
40816ES03 |
1 g |
||
|
细胞类型:293 |
40820ES04 |
1.5 mL |
|
|
40820ES10 |
10 mL |
||
|
40820ES60 |
100 mL |
||
|
细胞类型:293 核酸类型:DNA 用途:AAV/LV载体大规模生产 |
40821ES10 |
10 mL |
|
|
40821ES60 |
100 mL |
||
|
40821ES80 |
1 L |
使用产品已发表的部分文献
[1] Liu R, Yang J, et al. Optogenetic control of RNA function and metabolism using engineered light-switchable RNA-binding proteins. Nat Biotechnol. 2022 Jan 3. (IF:55)华东理工大学生物工程学院杨弋团队
[2] Luo J, Yang Q, et al. TFPI is a colonic crypt receptor for TcdB from hypervirulent clade 2 C. difficile. Cell. 2022 Mar 17.(41.582)西湖大学陶亮团队
[3] Zhou J, Chen P, et al. Cas12a variants designed for lower genome-wide off-target effect through stringent PAM recognition. Mol Ther. 2022 Jan 5.(IF:11.454)武汉大学生命科学学院殷雷团队
[4] Chen S, Cao X, et al. circVAMP3 Drives CAPRIN1 Phase Separation and Inhibits Hepatocellular Carcinoma by Suppressing c-Myc Translation. Adv Sci (Weinh). 2022 Jan 24.(IF:16.808)中国科学院北京生命科学研究院赵方庆团队
[5] Gu C, Wang Y, et al. AHSA1 is a promising therapeutic target for cellular proliferation and proteasome inhibitor resistance in multiple myeloma. J Exp Clin Cancer Res. 2022 Jan 6.(11.161)南京中医药大学杨烨顾春艳团队
[6] Zhang Y, Yu X, et al. Splicing factor arginine/serine-rich 8 promotes multiple myeloma malignancy and bone lesion through alternative splicing of CACYBP and exosome-based cellular communication. Clin Transl Med. 2022 Feb.(11.492)南京中医药大学杨烨顾春艳团队
[7] Qin J, Cai Y, et al. Molecular mechanism of agonism and inverse agonism in ghrelin receptor. Nat Commun. 2022 Jan 13.(14.9)四川大学生物治疗国家重点实验室邵振华团队
[8] Tang X, Deng Z, et al. A novel protein encoded by circHNRNPU promotes multiple myeloma progression by regulating the bone marrow microenvironment and alternative splicing. J Exp Clin Cancer Res. 2022 Mar 8.(11.161)南京中医药大学杨烨顾春艳团队
[9] Xie F, Su P, et al. Engineering Extracellular Vesicles Enriched with Palmitoylated ACE2 as COVID-19 Therapy. Adv Mater. 2021 Oct 19. (IF:30.849)苏州大学生物医学研究院周芳芳团队和浙江大学生命科学研究院张龙团队
[10] Liang Y, Lu Q, et al. Reactivation of tumour suppressor in breast cancer by enhancer switching through NamiRNA network. Nucleic Acids Res. 2021 Sep 7.(IF:16.9)复旦大学生物医学研究院于文强团队
[11] Fan Y, Wang J, et al. CircNR3C2 promotes HRD1-mediated tumor-suppressive effect via sponging miR-513a-3p in triple-negative breast cancer. Mol Cancer. 2021 Feb 2.(IF:27.403)南京医科大学附属逸夫医院苏东明团队
[12] Dai L, Dai Y, et al. Structural insight into BRCA1-BARD1 complex recruitment to damaged chromatin. Mol Cell. 2021 Jul 1.(IF:17.97)浙江大学生命科学研究院黄俊团队和中科院生物物理所周政团队
[13] Zhang K, Wang A, et al. UBQLN2-HSP70 axis reduces poly-Gly-Ala aggregates and alleviates behavioral defects in the C9ORF72 animal model. Neuron. 2021 Jun 16.(IF:17.17)中国科学院生物与化学交叉研究中心王文元团队
[14] Li T, Chen X, et al. A synthetic BRET-based optogenetic device for pulsatile transgene expression enabling glucose homeostasis in mice. Nat Commun. 2021 Jan 27.(IF:14.92)华东理工大学生物工程学院杨弋团队
[15] Pan Y, He X, et al. Neuronal activity recruits the CRTC1/CREB axis to drive transcription-dependent autophagy for maintaining late-phase LTD. Cell Rep. 2021 Jul 20.(IF:9.420)浙江大学脑科学与脑医学学院马欢团队
[16] Liu H, Xing R, et al. G-protein-coupled receptor GPR17 inhibits glioma development by increasing polycomb repressive complex 1-mediated ROS production. Cell Death Dis. 2021 Jun 12.(IF:8.463)厦门大学生命科学学院陈颖团队
[17] Yan F, Huang C, et al. Threonine ADP-Ribosylation of Ubiquitin by a Bacterial Effector Family Blocks Host Ubiquitination. Mol Cell. 2020 May 21.(IF:17.97)浙江大学生命科学研究院朱永群团队
[18] Luo Q, Wu X, et al. TRIM32/USP11 Balances ARID1A Stability and the Oncogenic/Tumor-Suppressive Status of Squamous Cell Carcinoma. Cell Rep. 2020 Jan 7.(IF:9.42)中国医学科学院分子肿瘤学国家重点实验室刘芝华团队
[19] Sun X, Peng X, et al. ADNP promotes neural differentiation by modulating Wnt/β-catenin signaling. Nat Commun. 2020 Jun 12.(IF:14.911)中国科学院水生生物研究所孙玉华团队
[20] Yang X, Wang H, et al. Rewiring ERBB3 and ERK signaling confers resistance to FGFR1 inhibition in gastrointestinal cancer harbored an ERBB3-E928G mutation. Protein Cell. 2020 Dec.(IF:14.872)浙江大学医学院/转化医学研究院闵军霞团队
[21] Zou Y, Wang A, et al. Analysis of redox landscapes and dynamics in living cells and in vivo using genetically encoded fluorescent sensors. Nat Protoc. 2018 Oct.(IF:13.490)华东理工大学生物工程学院杨弋、赵玉政团队
[22] Hao H, Hu S, et al. Loss of Endothelial CXCR7 Impairs Vascular Homeostasis and Cardiac Remodeling After Myocardial Infarction: Implications for Cardiovascular Drug Discovery. Circulation. 2017 Mar 28.(IF:29.69)中国医学科学院/北京协和医学院阜外医院王淼团队
