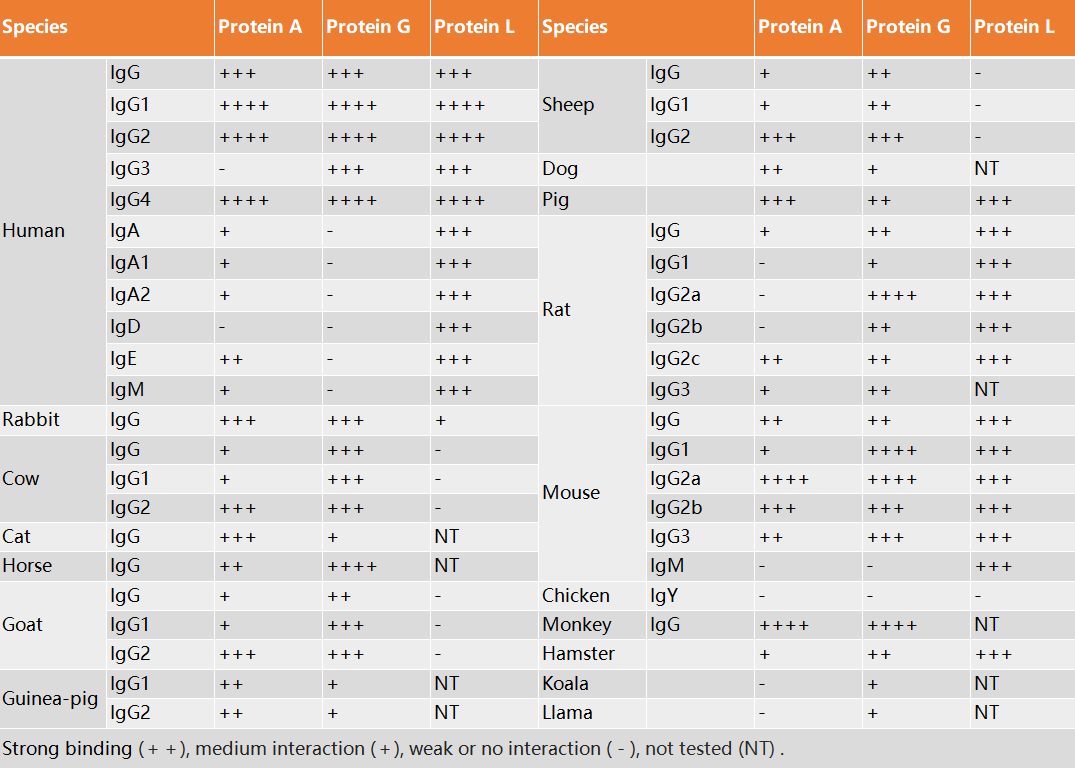
在细菌表面可分泌表达特殊功能蛋白与免疫球蛋白特异结合,主要分为Protein A金黄色葡萄球菌蛋白 A(Staphylococcal proteinA, SPA)、Protein G链球菌G群的细胞表面蛋白 G(Streptococcal protein G, SPG)和Protein L大消化链球菌蛋白 L(Peptostreptococcus protein L, PPL),均为典型的免疫球蛋白结合蛋白。可结合大多数哺乳动物的免疫球蛋白,其结合方式和结合谱有所差异,三种蛋白可以优势互补,灵活应用。
新产品借助天然蛋白结构域分析,特异设计与之对应的重组蛋白产品,具有高纯度,低内毒素以及无外源引入IgG等特点,使之在免疫学相关研究与生产中发挥巨大作用。
图1. Yeasen 的Protein系列重组蛋白
作为应用较为广泛的亲和配基使用,研究工作者分别解析其区域结合域,具体如下:
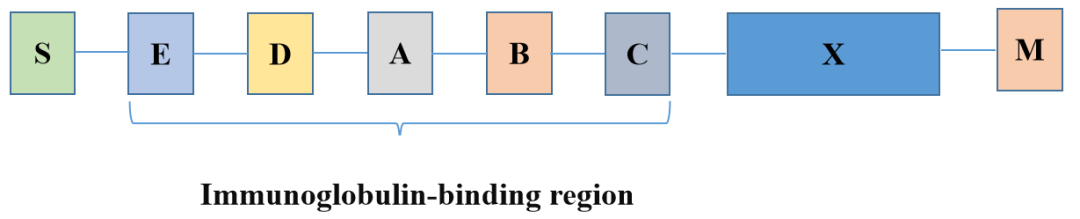
重组蛋白Protein A由大肠杆菌表达体系获得,功能与SPA 基本相同,由5个 IgG 结合结构域 E-D-A-B-C 串联排列组成,对 IgG 的 Fc 片段具有很强的特异性亲和力。重组蛋白Protein A 作为亲和配基被偶联到基质上,可以特异性的和样品中的抗体分子结合,而使其他杂蛋白流穿,具有极高的选择性。
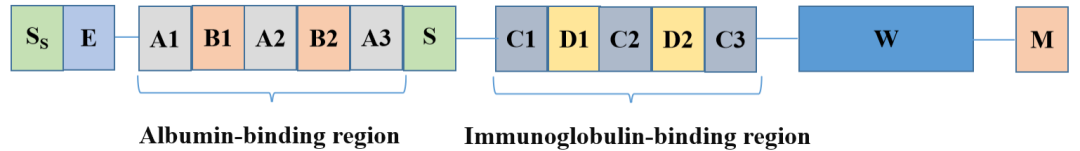
重组蛋白Protein G从大肠杆菌表达体系中获得,含有SPG 的 3 个 IgG 结合区。为确保 IgG 的最大特异性结合,重组蛋白Protein G 中细胞壁结合区、细胞膜结合区和白蛋白结合区已被去除,减少了交叉反应和非特异性结合。重组蛋白Protein G 被广泛与树脂偶联的配体,用作纯化多克隆或单克隆 IgG 抗体。
重组蛋白Protein L 类似于PPL包含 5 个 kappa 结合结构域。具有独特的通过 kappa 轻链相互作用结合而不干扰抗体-抗原结合位点。重组蛋白 Protein L 中去除了细胞壁结合区、细胞膜结合区和白蛋白结合区,以确保最大程度 IgG 的特异性结合。
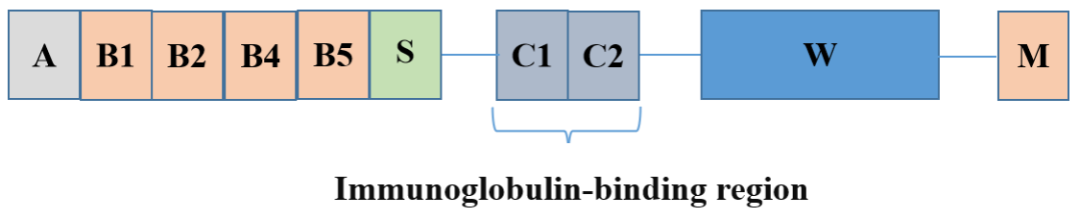
重组蛋白Protein A/G在大肠杆菌中产生,由 7 个 IgG 结合结构域 EDABC-C1C3 组成,对应于 5 个Protein A 的 IgG 结合区和 2 个Protein G 的 IgG 结构域。重组蛋白Protein A/G 的结合能力比单独的蛋白 A 或蛋白 G 更广。
表1. Protein A、G 和 L 对不同物种 Ig 的结合能力总表
1. 低内毒素:经LAL法检测,均< 0.1EU/μg。
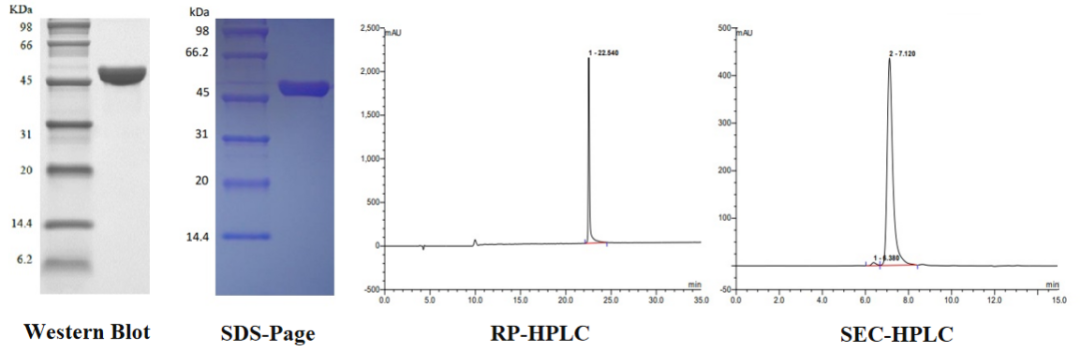
2. 高纯度:均>96%,经SDS-PAGE和HPLC双重检测。
3. 产品形态:冻干粉,相比于液体,冻干粉产品稳定性更好,更易长时间储存。
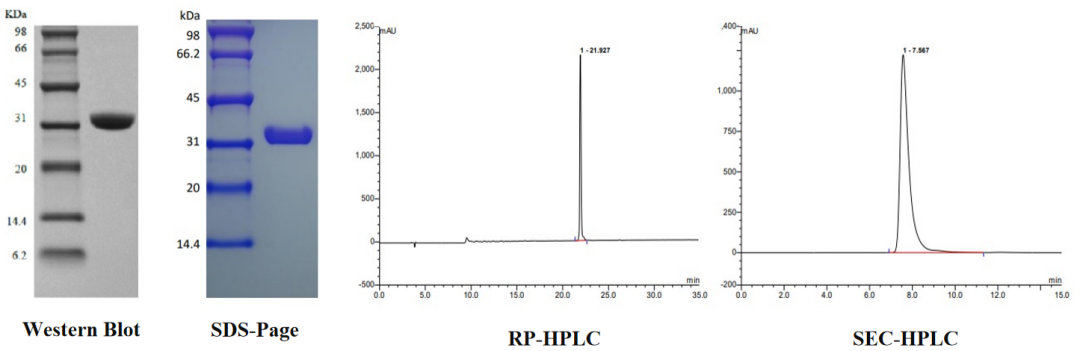
重组蛋白Protein A 经 SDS-PAGE 和 HPLC 双重检测,纯度>97%
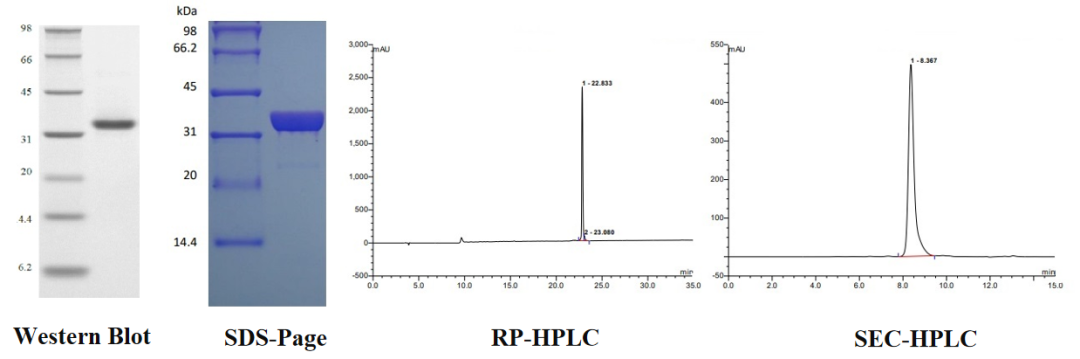
重组蛋白Protein G 经 SDS-PAGE 和 HPLC 双重检测,纯度>96%
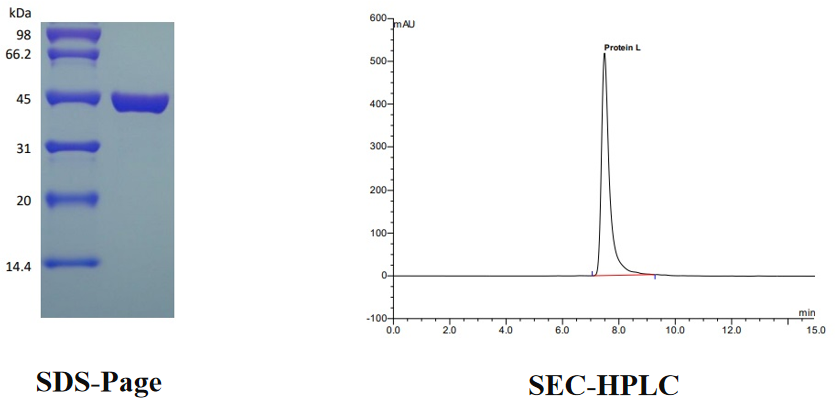
重组蛋白Protein L 经 SDS-PAGE 和 HPLC 双重检测,纯度>97%
重组蛋白Protein A/G 经 SDS-PAGE 和 HPLC 双重检测,纯度>97%