Western Blot蛋白免疫印迹(WB)快速实验攻略
Western Blot实验原理
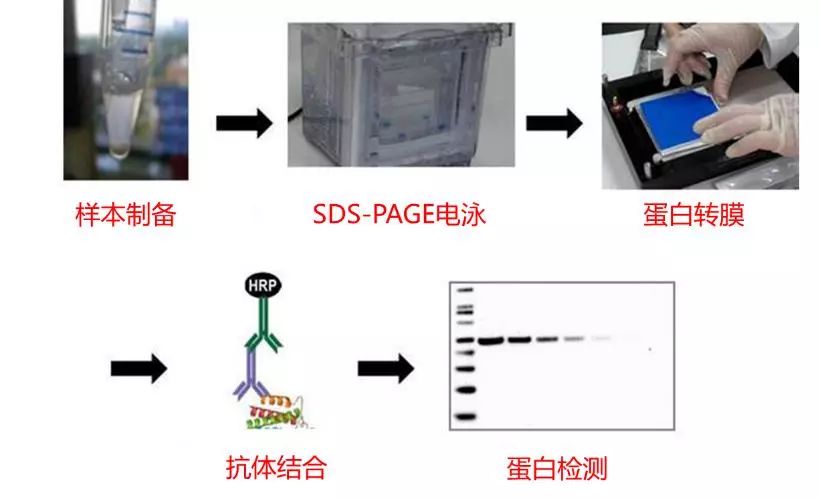
蛋白免疫印迹(Western Blot,WB)是将蛋白质经电泳分离后转移到膜上,然后利用抗体进行检测的技术。完整的WB流程,如下图所示,包含样本制备、SDS-PAGE、转膜、抗体结合、蛋白检测等5个大步骤。
实验步骤
1. 样本制备
1)融解RIPA裂解液(RIPA裂解液-细胞/组织裂解液缓冲液),混匀。取适当量的裂解液,在使用前数分钟内加入PMSF,使PMSF的最终浓度为1mM。
2)贴壁细胞:去除培养液,用PBS、生理盐水或无血清培养液洗一遍。按照6孔板每孔加入150-250μL裂解液的比例加入裂解液。用枪吹打数下,使裂解液和细胞充分接触。细胞充分裂解后应无没有明显的细胞沉淀。
悬浮细胞:离心收集细胞,用手指把细胞用力弹散。按照6孔板每孔细胞加入150-250 μL裂解液的比例加入裂解液。再用手指轻弹以充分裂解细胞。充分裂解后应没有明显的细胞沉淀。如果细胞量较多,必需分装成0.5-1X106个细胞/管,然后再裂解。
组织样本:按照每20 mg组织加入150-250μL裂解液的比例加入裂解液。用玻璃匀浆器匀浆,直至充分裂解。
3)充分裂解后,10000-14000g离心3-5min,取上清,即可进行后续的PAGE、Western和免疫沉淀等操作。
【注】:RIPA裂解液的裂解产物中经常会出现一小团透明胶状物,属正常现象。该透明胶状物为含有基因组DNA等复合物。在不检测和基因组DNA结合特别紧密的蛋白的情况下,可以直接离心取上清用于后续实验;如果需要检测和基因组结合特别紧密的蛋白,则可以通过超声处理打碎打散该透明胶状物,随后离心取上清用于后续实验。如果检测一些常见的转录因子,例如NF-kappaB、p53等时,通常不必进行超声处理,就可以检测到这些转录因子。
2. 蛋白定量
1)配制BSA标准品体系
标准品稀释液为蛋白样品的溶解液,原则上蛋白样品在什么溶液中,标准品也宜用什么溶液稀释。但也可用0.9%的NaCl或1XPBS进行稀释。BSA标准品体系配制可参考下表。
表1 BSA标准品体系配制(微孔板检测,线性范围20-2000μg/mL)*
|
Vial |
稀释液体积(μL) |
2mg/mL BSA体积(μL) |
BSA终浓度(μg/mL) |
|
A |
0 |
100 |
2000 |
|
B |
25 |
75 |
1500 |
|
C |
50 |
50 |
1000 |
|
D |
125 |
75 |
750 |
|
E |
150 |
50 |
500 |
|
F |
350 |
50 |
250 |
|
G |
375 |
25 |
125 |
|
H |
395 |
5 |
25 |
|
I |
400 |
0 |
0=Blank |
*如用比色皿检测,每管需加100μL标准品,按3个重复计算,每个浓度至少需配制300μL。
2)各取25μL标准品和待测样品加入到微孔板中。
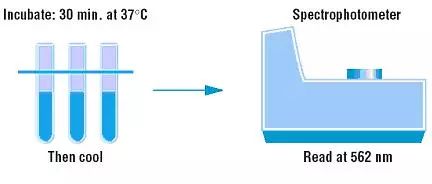
3)每孔加入200μL BCA工作液,振荡30s充分混匀。盖上微孔板,37℃孵育30min。
4)冷却到室温,在酶标仪上的540-595nm波长范围处检测吸光度,其中562nm波长为最佳。
5)根据BSA标准品的吸光度(减去标准品中空白孔的OD值即最终的读数),绘制标准曲线(X-蛋白浓度ug/mL;Y-最终的OD562nm)。依据标准曲线和样品的稀释倍数计算样品蛋白浓度。
3. 蛋白电泳
1)剪开包装取出预制胶,撕去胶板底端橙色胶纸,将预制胶固定在电泳槽中,内槽加满tris-glycine电泳缓冲液,外槽液面低于内槽5-10mm,双手按住梳子左右部位将其平稳缓慢(一定要慢,否则会将胶齿拔断或拔歪)拔出。
2)在室温或不超过37℃的水浴中溶解5XSDS-PAGE上样缓冲液。水浴溶解后立即室温存放。
3)按照每4 μL蛋白样品加入1μl 5XSDS-PAGE 蛋白上样缓冲液的比例,混合蛋白样品和5XSDS-PAGE蛋白上样缓冲液。
4)100℃或沸水浴加热 3-5min,以充分变性蛋白,之后冷却至室温备用。
5)在每个样品孔中上样20-40µg蛋白,并在1个孔中上样蛋白marker,盖上电泳槽盖,打开电源,推荐使用低压100V,跑15min,之后换高压150V跑,通常电泳至蓝色染料到达胶的底端处附近即可停止电泳。
6)电泳后取出胶板,用刀在侧边硅胶处,沿着两片玻璃缝隙切开硅胶,即可打开玻璃板;取胶时,需在胶和玻璃条之间,沿着玻璃条划一刀,防止发生粘连。掰开两板,将胶取出,此时蛋白会从凝胶上慢慢扩散,因此不要保存在凝胶里,要迅速进行下一步的转移操作。
4. 转膜与封闭
1)将胶浸于预冷的转膜缓冲液中平衡5min。(如果检测小分子蛋白质,可省略该步骤,因小分子蛋白容易扩散)。
2)依据胶的大小剪取膜和滤纸6片,放入预冷的转膜缓冲液中平衡10min,如用PVDF膜,需参照说明书,先用纯甲醇浸泡1-2min,再孵育于预冷的转膜缓冲液中。(膜的选择:0.45μm孔径,用于一般蛋白;0.2μm孔径,用于分子量小于20kD蛋白;0.1μm孔径,用于分子量小于7kD蛋白)
3)装配转移三明治:海绵/3层滤纸/胶/膜/3层滤纸/海绵,每层放好后,用试管赶尽气泡。
4)将转移槽置于冰浴中,放入三明治,膜靠近阳极,胶靠近阴极,加入转移缓冲液,插上电极,100V,1h(电流约为0.3A)。
5)转膜结束后,切断电源,取出膜。
6)将膜浸没在5mL丽春红染色液中,置于轨道摇床上室温染色5~10min或更长,直待膜上显示出蛋白条带。注:如果没有出现染色条带,则表示转膜失败,可能需要重新转膜或重新上样电泳。
7)清洗:取出膜,用蒸馏水,PBS或者其他适当溶液冲洗至背景清晰后拍照,大概冲洗2~3次,每次5min。
8)脱色:将膜放到0.1N NaOH溶液漂洗5min;倒去洗脱液,再重复一次。
9)清洗:再用蒸馏水清洗膜2~3次,每次5min。
10)将膜置于25mL封闭缓冲液中,在室温下孵育1小时。
11)用5mL TBST洗涤三次,每次15min。
5. 抗体孵育与检测
1)将膜和一抗(按照产品应用推荐稀释度)置于10mL一抗稀释缓冲液中在4°C下孵育过夜并不时轻轻晃动。
2)用5mL TBST洗涤三次,每次15min以去除残留的一抗。
3)将膜和二抗(按照产品应用推荐稀释度)置于10mL封闭缓冲液中孵育1-2小时并不时轻轻晃动。
4)用5mL TBST洗涤三次,每次15min。
5)最后一次洗膜的同时,按照ECL超敏试剂盒说明书,新鲜配制发光工作液。
6)用平头镊取出膜,搭在滤纸上沥干洗液,勿使膜完全干燥。将膜完全浸入发光工作液(125μL发光工作液/cm2膜)中,与发光工作液充分接触。室温孵育3min,准备立即压片曝光。
7)用镊子夹起膜,搭在滤纸上沥干发光工作液。但勿洗去发光液。
8)在X光胶片暗盒内表面铺一张面积大于膜的保鲜膜。将印迹膜贴在保鲜膜上,将保鲜膜折起来完全包裹印迹膜,去除气泡和皱褶,可剪去边缘部多余的保鲜膜。用滤纸吸去多余的发光工作液。用胶带将覆盖印迹膜的保鲜膜固定在暗盒内,蛋白带面向上。
9)暗房内压X光胶片,分别曝光不同的时间,如数秒到数分钟。显影冲洗。(从刚开始的10s曝光时间中可以看出适当的曝光时间。由于检测反应的动力学特征,在孵育后信号立即变得最强,但在随后的2小时内会减弱)
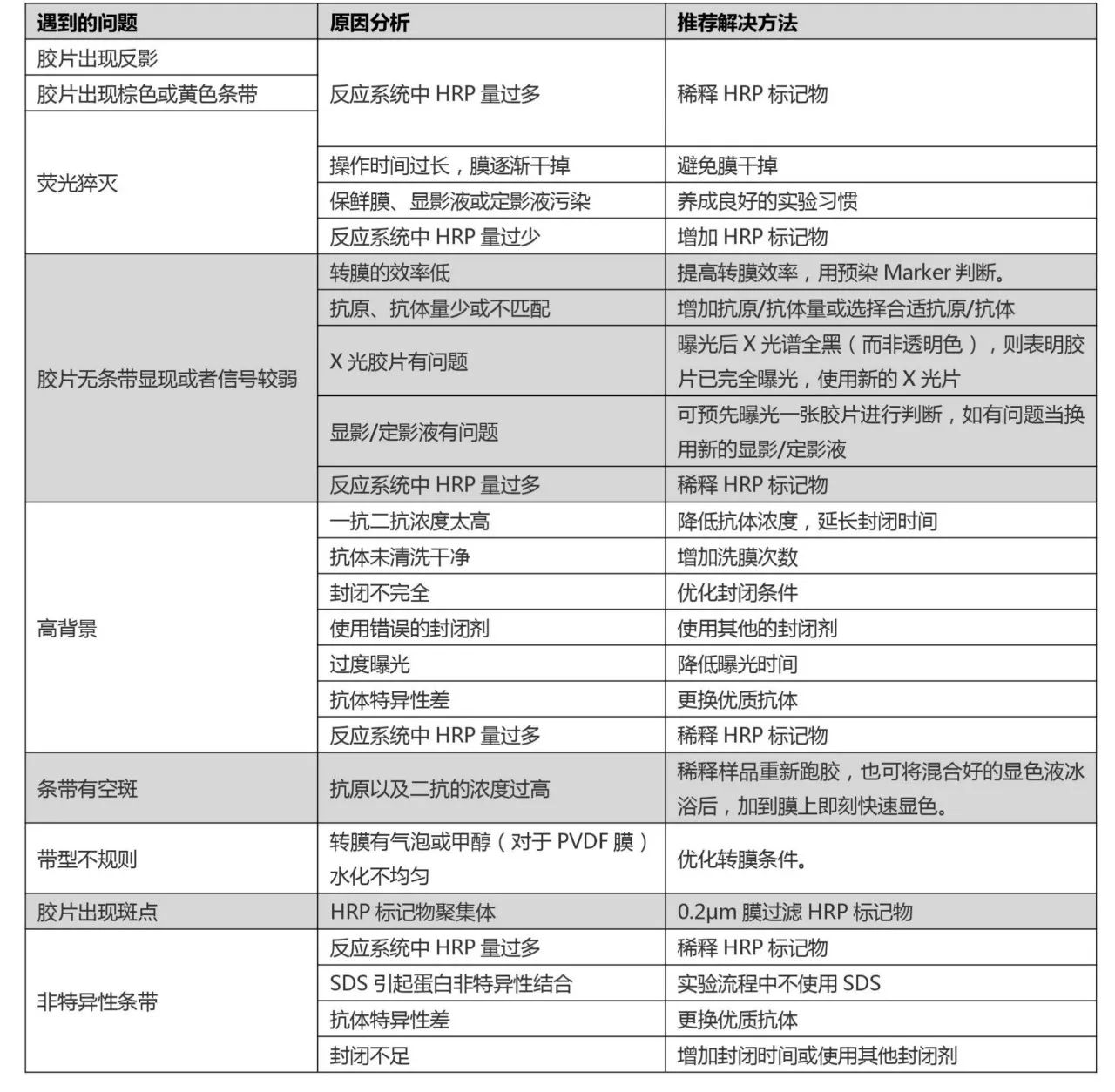
常见问题
附录:Western Blot快速实验试剂准备
1. 各类缓冲液
1)电泳缓冲液:10xTris-Glycine-SDS电泳缓冲液(20319ES76),或参考配方1X:25 mM Tris, 192 mM Glycine, 0.1% SDS, pH 8.3
2)电转缓冲液:Western Blot电泳电转通用缓冲液(20329ES03),或参考Tris-Glycine缓冲液配方
3)蛋白上样缓冲液:5XSDS-PAGE蛋白上样缓冲液(20315ES05),或参考配方1X:0.25MTris-HCL(pH6.8), 10%(W/V)SDS, 0.5%(W/V) BPB(溴酚蓝), 50%(V/V) 甘油, 5%(W/V)β-巯基乙醇(2-ME)/DTT
4)其他缓冲液:PBS,TBST
2. 样本制备
1)细胞裂解液:RIPA(20101ES60,或20115ES60,或20114ES60)
2)蛋白酶抑制剂:PMSF(20104ES03)
3. 蛋白定量
1)蛋白定量试剂:BCA蛋白定量试剂盒(20201ES76)
4. 蛋白电泳
1)预制胶:4-20%高分辨率梯度预制胶,10孔(36231ES10)
2)蛋白marker:三色预染蛋白分子标准(10-245kDa)(20352ES76)
5. 转膜与封闭
1)膜(自备)
2)膜上蛋白检测:丽春红染色液(36221ES60)
3)膜的封闭:BSA,无IgG(36103ES25)
6. 抗体孵育
1)抗体:内参抗体、一抗、二抗(例:30101ES10,30401ES10,34101ES60)
2)检测试剂:ECL化学发光超敏显色试剂盒(36208ES60)
相关产品推荐
|
产品名称 |
产品编号 |
规格 |
|
20123ES10 |
1瓶(10片) |
|
|
20123ES50 |
1瓶(50片) |
|
|
InStabTM Protease Inhibitor Cocktail, EDTA-free, 100×DMSO Stock Solution |
20124ES03 |
1 mL |
|
20124ES10 |
10×1 mL |
|
|
20124ES60 |
100×1 mL |
|
|
InStabTM Phosphatase Inhibitor Cocktail (100×, Stock Solution) |
20109ES05 |
2 mL |
|
20109ES20 |
10×2 mL |
|
|
20109ES70 |
100×2 mL |
|
|
20126ES50 |
50 T |
|
|
20126ES60 |
100 T |
|
|
20127ES50 |
50 T |
|
|
20127ES60 |
100 T |
|
|
20325ES62 |
125 mini gels |
|
|
20325ES62 |
125 mini gels |
|
|
36222ES60 |
100 mL |
|
|
36222ES76 |
500 mL |