探秘细胞凋亡-细胞凋亡检测工具大盘点
细胞凋亡是一个神秘的过程,在机体内时刻进行着

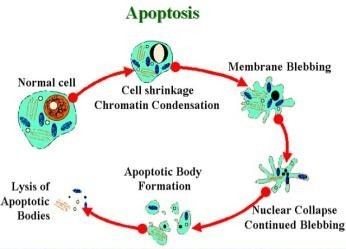
细胞凋亡(Apoptosis)一般是指机体细胞在发育过程中或在某些因素作用下通过细胞内基因及其产物的调控而发生的一种程序性细胞死亡过程。 细胞凋亡途径中各事件的发生是有时序性的,即各事件按先后顺序依次发生,最终导致凋亡小体的出现,细胞随后发生凋亡。细胞凋亡对胚胎发育及形态发生(morphogenesis)、组织内正常细胞群的稳定、机体的防御和免疫反应、疾病或中毒时引起的细胞损伤、老化、肿瘤的发生进展起着重要作用,并具有潜在的治疗意义。
图1:细胞凋亡过程
>>>>探秘细胞凋亡-细胞凋亡检测工具大盘点
细胞凋亡的三个典型特征:
细胞处于不同的凋亡阶段具有不同的生物学特征,典型的特征包括:
1 )细胞膜PS(磷脂酰丝氨酸)外翻;
2)线粒体膜电位丧失;
3)细胞核浓缩和断裂
想要探秘凋亡处于哪个阶段,小编为您支三招。
工具1——凋亡早期检测
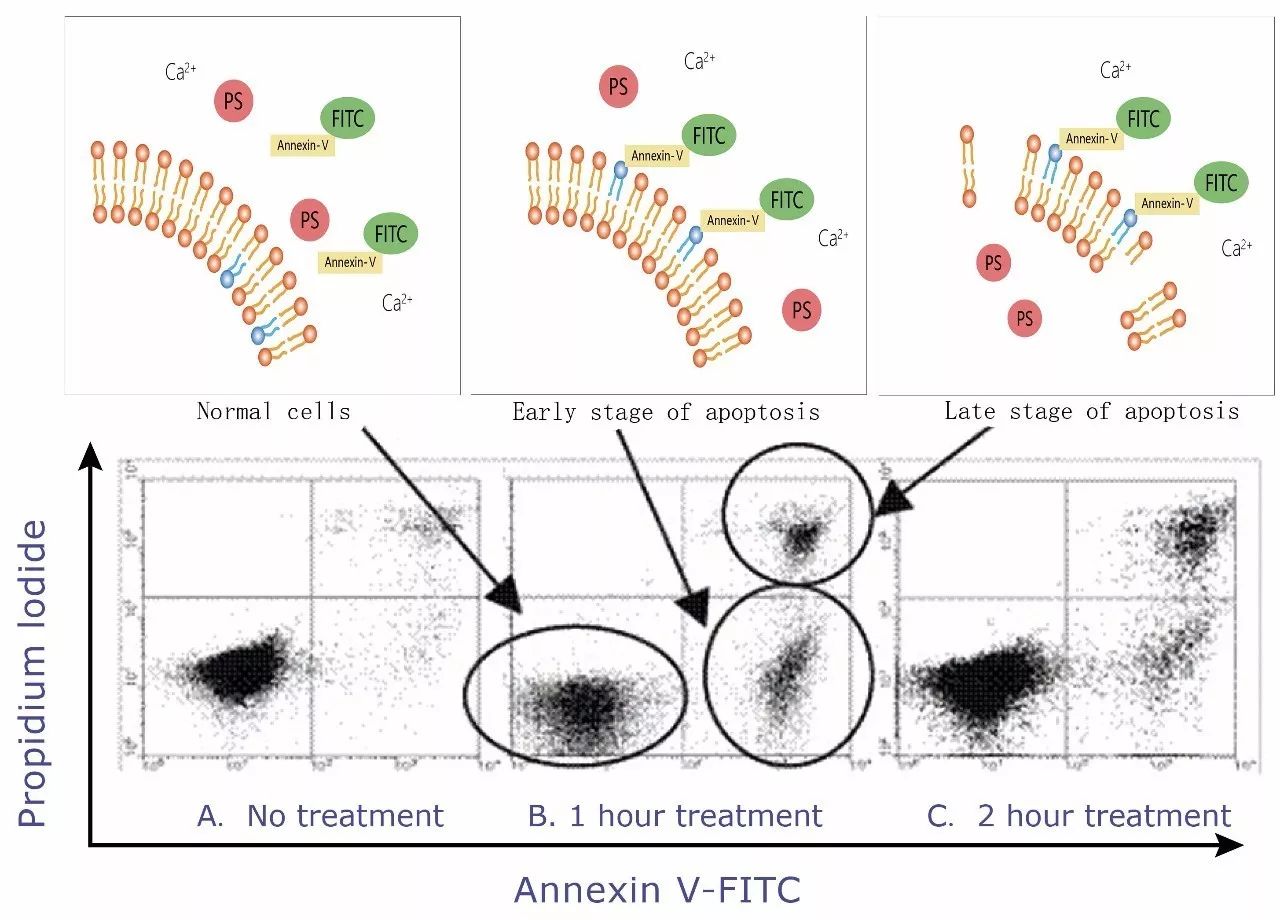
在正常细胞中,磷脂酰丝氨酸(Phosphotidylserine, PS)位于细胞膜内侧,但在早期凋亡的细胞中,PS由细胞膜的内侧翻转到细胞膜表面,暴露在细胞外环境中。Annexin-Ⅴ(膜联蛋白-V)是一种分子量为35-36 kDa的Ca2+依赖性磷脂结合蛋白,能与PS高亲和力结合,通过细胞外侧暴露的磷脂酰丝氨酸与凋亡早期细胞的胞膜结合。
检测方法:用荧光素(FITC、Alexa Fluor488等)标记的 Annexin-V 作为探针,利用流式细胞仪或荧光显微镜可检测细胞凋亡的发生。另外,碘化丙啶(propidine iodide, PI)是一种核酸染料,它不能透过完整的细胞膜,但在凋亡中晚期的细胞和死细胞,PI 能够透过细胞膜而使细胞核红染。因此将 Annexin-V 与 PI 匹配使用,就可以将凋亡早晚期的细胞以及死细胞区分开来。
工具2——凋亡中期检测
线粒体膜电位的丢失导致线粒体膜中线粒体通透性转换孔的开放,细胞色素C(Cytochrome C)被释放到细胞浆中,致使Caspase被激活从而诱导细胞凋亡。
检测方法:JC-1是一种广泛用于检测线粒体膜电位(△Ψm )的理想荧光探针,表现出电势依赖性的积聚在线粒体内。正常线粒体内,JC-1聚集在线粒体基质中形成聚合物,聚合物发出强烈的红色荧光;而在凋亡细胞中,线粒体跨膜电位去极化,JC-1从线粒体内释放,浓度降低,逆转为发射绿色荧光的单体形式。因此颜色的变化将直接反映出线粒体膜电位的变化。线粒体的去极化程度也可以通过红/绿荧光强度的比例来衡量。JC-1的流式检测是比较常见的一种方法。
工具3——凋亡晚期检测
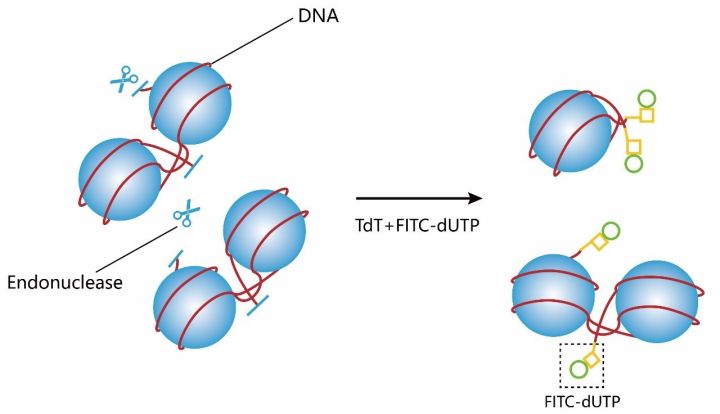
细胞凋亡晚期,染色体DNA双链断裂或单链断裂而产生大量的粘性3’-OH末端,可在脱氧核糖核苷酸末端转移酶(TdT)的作用下,将荧光素/酶标记的dUTP结合到DNA的3‘--OH末端,从而可进行凋亡细胞的检测,这类方法称为脱氧核糖核苷酸末端转移酶介导的缺口末端标记法(terminal -deoxynucleotidyl transferase mediated nick end labeling,TUNEL)
细胞凋亡检测三把斧,您get到了吗?
附上小编一些检测实验TIPS
AnnexinV/PI检测
Q:Annexin V/ PI 试剂盒能否检测除人以外其他动物细胞凋亡情况?
A:可以。因为Annexin V 是与磷脂酰丝氨酸(PS)的结合,而PS不存在种属间差异。
Q:使用Annexin V/ PI 试剂盒进行凋亡检测,用含EDTA 的胰酶消化细胞对结果有影响吗?
A:会。因为Annexin V 是Ca2+依赖的蛋白,EDTA会 螯合Ca2+从而影响Annexin V与PS 的结合,进而影响实验结果。
Q:如果细胞自带GFP蛋白,请问哪种凋亡检测试剂盒适用该细胞的凋亡检测?
A:选用PE标记或者APC标记的Annexin V凋亡检测试剂。
Q:对于来自血液的细胞样品,为什么去除血液中的血小板?
A:因为血小板中含有PS,其能与Annexin V结合进而干扰实验结果。
Q:Annexin -V 在实验操作上应注意哪些事项?
A:由于Annexin -V染料上带有荧光基团,在实验操作上应尽量避光操作和孵育;为保证实验结果的正确性应在染色后1h内上机检测。
TUNEL检测
Q:组织切片厚度多少比较合适?
A:组织切片过厚,会使得固定效果不理想,最好控制在10 μm以内。
Q:除了多聚甲醛固定,可不可以使用甲醇固定?
A:使用乙醇或甲醇固定会导致标记的效率较低。酸性固定液,也容易导致假阳性的出现。建议采用新鲜配置的4%中性多聚甲醛固定液。
Q:如何避免出现非特异性荧光标记?
A:(1)对于本身核酶或聚合酶活性水平较高的组织/细胞,例如平滑肌细胞,建议取细胞或组织后立即固定并且要充分固定,以阻止这些酶导致假阳性。
(2)在进行末端标记的时候,保证细胞或组织表面保持湿润,检测反应液能很好地覆盖样品。
Q:Tunel检测在实验操作上有哪些注意事项?
A:荧光基团长期暴露在普通光照下,会发生严重淬灭,因此在实验操作上应尽量避光操作和孵育。
荧光补偿的调节:
Q:光补偿调节的原则?
A: 1)用于调节补偿的样本必须单染。
2)用来调节补偿的荧光素必须与实验用的荧光素一样(例如不能用FITC调节EGFP的补偿)。
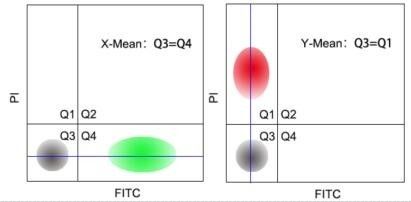
3)横平竖直:理论上X-Mean或者Y-Mean要相等(如图所示),但在实际操作中,只需要保证单染的细胞不跨区存在。
A:进行荧光补偿的调节,需要设置几组对照实验。以AnnxinV-FITC/PI双染试剂盒为例;Q:如何进行光补偿的调节?
1)空白对照组:不进行任何标记的细胞,用于电压的调节,调整前向散射和侧向散射,得到清晰划分的细胞群体。
2)凋亡诱导的单染组:阳性对照的细胞群体需要超过分析的细胞群体的10%,用于调节补偿。
3)双染实验组:利用空白对照组和单染组调节好的参数进行实验数据的获得。
|
类型 |
品名 |
货号 |
规格 |
|
早期凋亡 |
40302ES20/50/60 |
20T/50T/100T |
|
|
40303ES20/50/60 |
20T/50T/100T |
||
|
40304ES20/50/60 |
20T/50T/100T |
||
|
40305ES20/50/60 |
20T/50T/100T |
||
|
40310ES20/50/60 |
20T/50T/100T |
||
|
中期凋亡 |
40705ES03/08 |
1mg/5mg |
|
|
40707ES03/08 |
1mg/5mg |
||
|
40706ES60 |
100T |
||
|
晚期凋亡 |
40306ES20/50/60 |
20T/50T/100T |
|
|
40307ES20/50/60 |
20T/50T/100T |
||
|
40308ES20/50/60 |
20T/50T/100T |