浅谈DNA磁珠的作用原理
作为DNA分选磁珠的生产厂商,我们经常被客户问到的问题就是:高通量测序(NGS)文库制备时,DNA磁珠为什么可以用来纯化和分选文库?在这里我们整理相关的资料,对这个问题做简单的阐述。
分选磁珠的作用原理是基于一种固相载体可逆化固定(SPRI)的分离纯化方法。磁珠体系中一般包含:磁珠、DNA、聚乙二醇(PEG)、以及盐离子等,在一定浓度的PEG和盐离子环境中,DNA可吸附到羧基修饰的高分子磁珠表面(即固相载体),该过程是可逆的,在适当条件下,结合的DNA分子可以被洗脱回收。
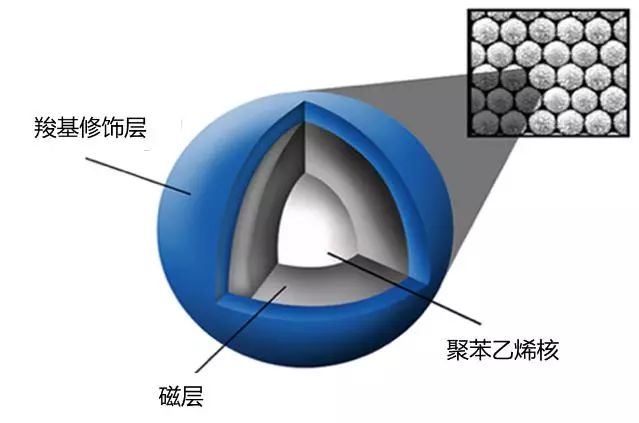
纳米级别的磁珠表面性质不同,分离原理也不尽相同,但基本上固态的球状材料组成并无太大差异,基础结构一般分为3层,最内层的核心是聚苯乙烯、第二层包裹磁性物质——四氧化三铁(Fe3O4),最外层表面是羧基(-COOH)修饰的高分子材料所构成,其中羧基行使与核酸结合的工作。
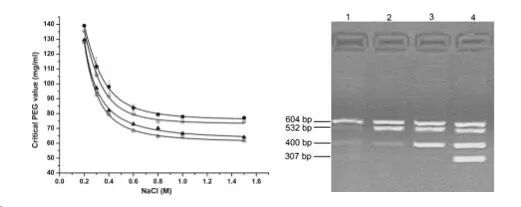
在整个体系中,PEG是影响DNA回收的决定性因素(其他因素还包括DNA大小和浓度、盐离子浓度、孵育时间等等)。DNA在一定浓度的PEG存在条件下,NaCl或MgCl2促进条件下,使DNA发生脱水反应,分子构象会发生急剧变化,由线状被压缩形成卷曲球状,继而聚集沉淀,同时随PEG分子量、浓度以及盐浓度的不同,不同长度的DNA可以被选择性的沉淀出来。在磁珠体系中,特定分子量的PEG的功能主要是与盐离子共同作用,改变不同长度DNA的分子构象,同时增加体系的粘稠程度,使磁珠存在其中处于悬浮状态,不易沉降,增加磁珠在空间位置的碰撞与排斥,从而增加核酸与磁珠的聚集效率与效果,除此之外,PEG与蛋白质具有相容性,也可去除样品中的蛋白质。
Fig[3]. critical PEG concentration versus NaCl concentration for different-size DNA fragments. DNA fragments: 307 bp (filled circles), 400 bp (open circles), 532 bp (filled triangles), and 604 bp (open triangles). Agarose gel electrophoresis: Lane 1, 68 mg/ ml PEG and 0.8 M NaCl; lane 2, 90 mg/ml PEG and 0.4 M NaCl; lane 3, 110 mg/ml PEG and 0.3 M NaCl; and lane 4, 110 mg/ml of PEG and 0.4 M NaCl.
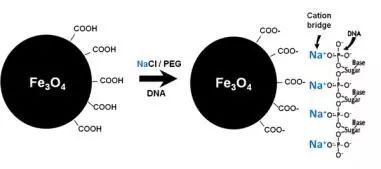
当处于PEG和盐离子环境中的DNA,因脱水作用而发生分子构象改变后,会暴露出磷酸骨架上大量的带负电荷的磷酸基团,与表面带负电荷的羧基磁珠结合,但如何解释负负电荷之间的作用,目前还不得而知。但普遍认为,这是由于带正电荷的盐离子的作用(如Na+)。带负电的磷酸基团借由解离的盐离子(如Na+)与羧基形成离子桥,使DNA被特异性吸附到羧基磁珠表面。当PEG和盐类被去除之后,加入水性分子,会快速充分水化DNA,解除其三者之间的离子相互作用,使得吸附到磁珠的DNA被纯化出来。
磁珠的出现,使得核酸制备的实验可以实现自动化,同时相较于传统的回收方式,还具有3个明显的优势:
1)效率更高,以DNA为例,1 mu/L磁珠的承载量可达7 mu/g;
2)避免使用有机溶剂,如酚类、氯仿等等,更加安全;
3)操作简单,无需离心,也更有利于保留核酸的完整性。
参考文献
1. Liu, Lingling, et al. "Size-selective separation of DNA fragments by using lysine-functionalized silica particles." Scientific reports 6 (2016): 22029.
2. He, Z. Y., Xu, H., Xiong, M. & Gu, H. Size-selective DNA Separation: Recovery Spectra Help Determine The Sodium Chloride (NaCl) and Polyethylene Glycol (PEG) Concentrations Required. J. Biotechnol. 9(2014), 1241–1249.
3. He, Z., Zhu, Y. & Gu, H. A New Method for The Determination of Critical Polyethylene Glycol Concentration for Selective Precipitation of DNA Fragments. Appl. Microbiol. Biotechnol. 97(2013), 9175–9183.
4. Froehlich, E., et al. "PEG and mPEG–anthracene induce DNA condensation and particle formation." The Journal of Physical Chemistry B 115.32 (2011): 9873-9879.
5. Hong-yang Yu. The Mechanism Study of Plasmid DNA abstraction based on SPRI. Biological Science,2003.
6. Sinclair B. To bead or not to bead: Applications of magnetic bead technology. Scientist, 13(1998):16.
7. Lis JT. Fractionation of DNA fragments by polyethylene glycol induced precipitation. Meth Enzymol 65(1980):347–353.
磁珠经过不同功能基团的有效包被,可实现对核酸的高通量、自动化提取,已广泛应用于基因测序、分子诊断等领域。翌圣生物根据目前市场磁珠需求,集中专业科研人员,致力于磁珠系列产品的创新开发,目前已经拥有多款高品质核酸磁珠类产品,可应用于基因测序、PCR、克隆等多种实验!
|
名称 |
完美替代AMPure Hieff NGSTM DNA Selection Beads |
高效回收50bp以上DNA Hieff NGSTM Smarter DNA Clean Beads |
有效解决cfDNA大片段污染问题 Hieff NGSTM cfDNA Clean Beads |
|
适用 |
100bp以上DNA |
50bp-20kb DNA |
100-200bp DNA |
|
适用实验 |
DNA文库构建 PCR产物纯化 酶切产物纯化 |
PCR产物纯化 酶切产物纯化 |
cfDNA文库构建 cfDNA纯化 |
|
货号 |
产品名称 |
规格 |
|
12600ES |
1 mL/5mL/60mL/450mL |