翌圣生物支原体qPCR检测试剂盒『快速 - 精准 - 合规』
相较于传统化学药物,以基因治疗、细胞治疗或组织工程为基础的新型生物治疗业已成为前沿性治疗药物。这些药物大多以细胞为载体制备或构建,因此,在此过程中,对于细胞种子库、病毒培养和收获、临床治疗用途的细胞等生物制品中生产制备过程易受到支原体污染。
据文献报道:支原体污染在储存细胞系中发生率约为 15-35%,在生物制药行业中约为0.44-6.70%。在这些污染事件中,95%的支原体种类是以下几种:口腔支原体、精氨酸支原体、猪鼻支原体、发酵支原体、人型支原体或莱氏无胆原体等[1]。
图:生物制品生产过程中支原体检测取样点
支原体污染对于生物制备企业来讲就如同梦魇一般,不仅导致产品品质下降;还会降低表达水平,最终导致产量降低,同时也会对患者产生不良的副作用,快速、精确的检测支原体的存在已然迫在眉睫。目前国内外药典推荐的支原体检测方法主要是基于培养法、NAT(核酸扩增法)法、细胞培养指示法[2]。
表:药典检测法优缺点对比[2,3]
|
方法类型 |
优点 |
缺点 |
|
培养法 |
高灵敏度,可检测到0.1CFU/mL |
时间过长,整个过程需28天 不同支原体需不同培养基进行培养,某些支原体难以培养 |
|
NAT法(核酸扩增) |
快速 达到10CFU/mL以下的检测限 |
需要特定提取试剂盒和检测设备 DNA的提取质量和效率影响结果的可信任度 需要其他方法如培养法进行可比验证 |
|
指示细胞培养法 |
成本低 操作较为简单 |
培养时间达一周左右 灵敏度低于培养法 存在假阳性和假阴性现象 |
翌圣生物经过匠心研发,基于EP药典推荐NAT法推出超简便快捷的qPCR支原体检测试剂盒,克服了普通PCR灵敏度低和培养法耗时久的问题,将结果精准度和使用便捷度有了质的提升!
翌圣生物支原体qPCR检测试剂盒可用于确定如细胞种子库、病毒培养和收获、临床治疗用途的细胞和生物制品中支原体污染过程和放行精确检测使用,3h内可快速、简便检测支原体存无,优于培养法的28天耗时检测过程。
产品特点
1 高灵敏度:支原体标准品验证灵敏度达10CFU/mL
2 操作简便:样本制备和检测总时长<3h
3 特异性好:多个亲缘关系相近物种验证无交叉反应
4 符合法规:检测方法和过程按照药典要求验证,符合法规要求
5 适用性广:检测105种支原体,适用多种样品(细胞、病毒、培养基、细胞制品等)
6 准确性高:探针法检测,避免染料法造成的假阳性问题,批次间稳定
7 安全性高:试剂盒内标准品无感染性,安全性好
产品数据
灵敏度和扩增效率测试
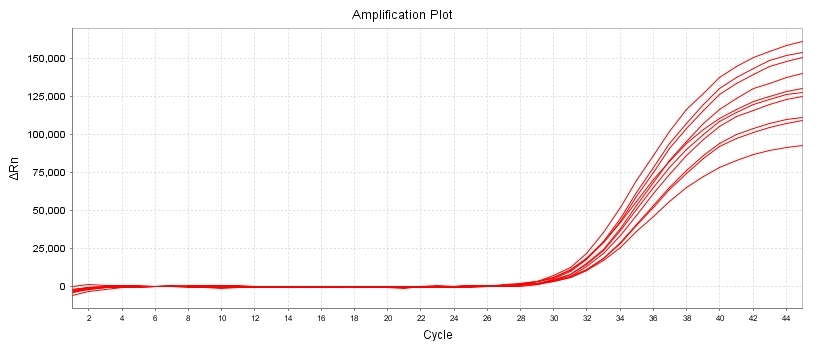
10 CFU/mL 口腔支原体标准品检出结果
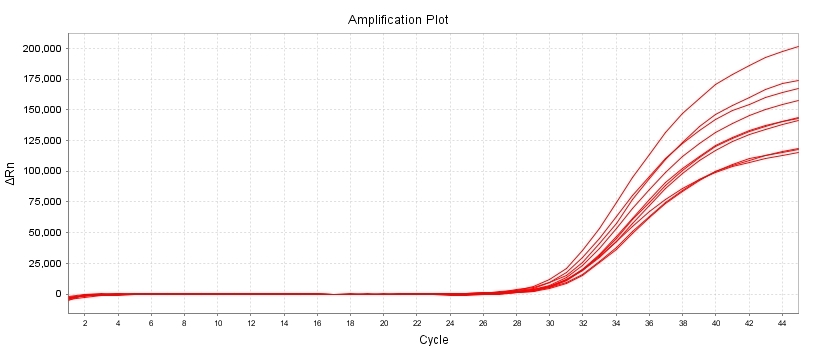
10 CFU/mL 肺炎支原体标准品检出结果
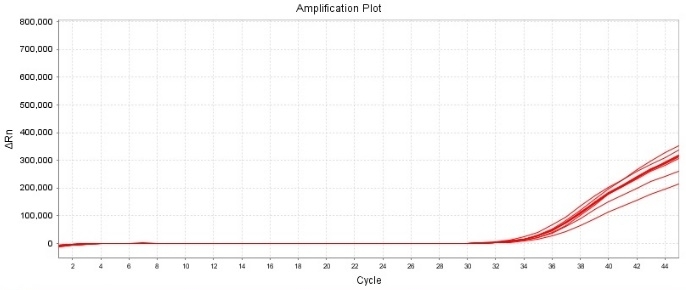
10 CFU/mL 猪鼻支原体标准品检出结果
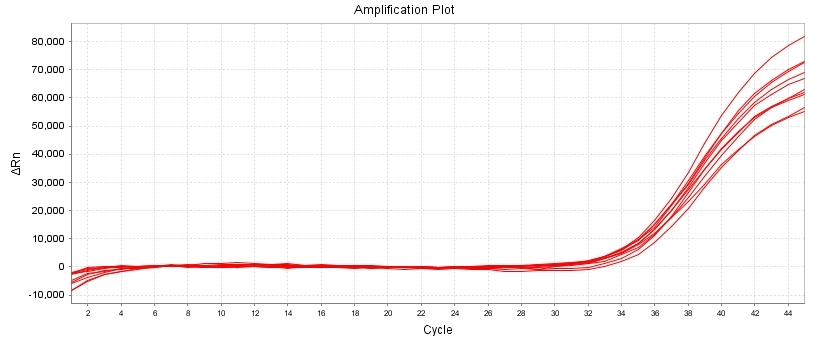
10 CFU/mL 精氨酸支原体标准品检出结果
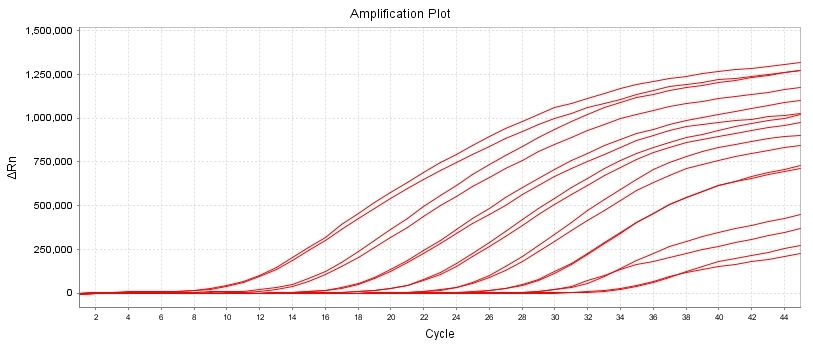
试剂盒扩增效率:lg-8lg copies/ul
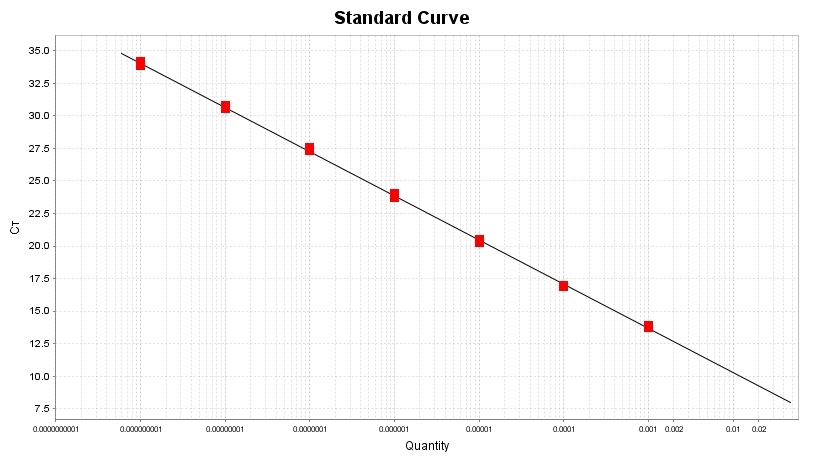
扩增效率≥96%,标准曲线R2≥0.996
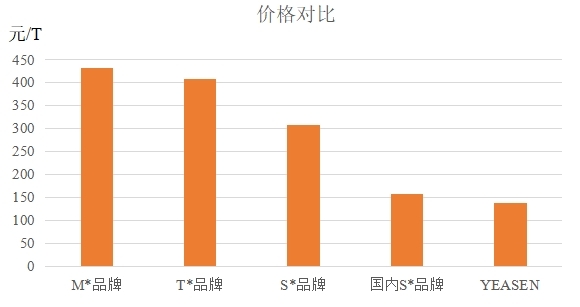
产品对比
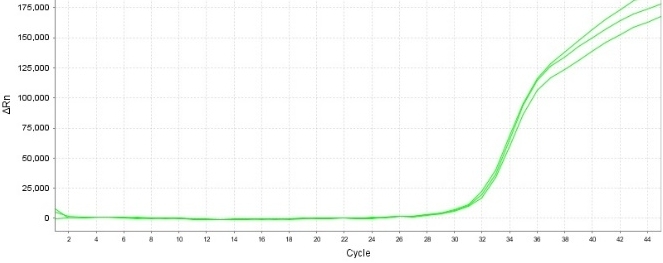
(S*品牌)
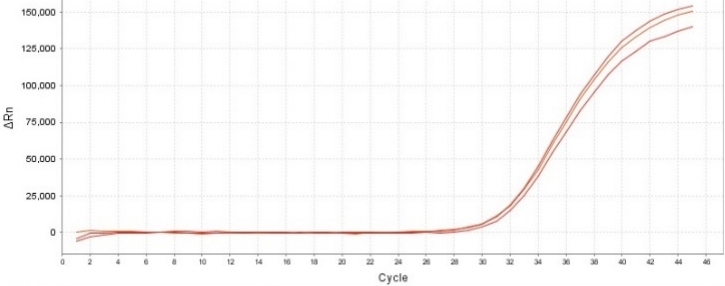
(YEASEN品牌)
10 CFU/mL 口腔支原体标准品检出结果
FAQ
Q:如何检测培养的细胞是否受到支原体污染?
A:培养细胞3天及以上取样品,提取DNA后,取20 μL 待测样本按说明书给定的操作程序进行,待qpcr反应结束后通过FAM和VIC通道信号的Ct值来判断样品是否受到支原体污染,如果FAM通道信号Ct<40 ,且有明显的扩增曲线,VIC通道信号Ct<40 ,且有明显的扩增曲线,说明样品有支原体污染。
订购信息
|
产品名称 |
产品编号 |
规格 |
|
40618ES25 |
25 T |
|
|
40618ES60 |
100 T |
相关产品
|
类别 |
产品 |
货号 |
规格 |
|
支原体检测 |
40601ES10/20 |
10/20 assays |
|
|
MycAwayTM Plus-Color One-Step Mycoplasma Detection Kit 一步法快速支原体检测试剂盒 |
40612ES25/60 |
25/100 T |
|
|
支原体去除 |
MycAway™ Treatment (1000×)-Mycoplasma Elimination Reagent MycAwayTM 支原体去除试剂(1000×) |
40607ES03/08 |
1/5×1 mL |
|
支原体预防 |
MycAway™ Prophylactic (2000×)-Mycoplasma Prevention MycAwayTM 支原体预防试剂(2000×) |
40608ES03/08 |
1/5×1 mL |
【文献引用】
[1] Fratz-Berilla EJ, Angart P, Graham RJ, et al. Impacts on product quality attributes of monoclonal antibodies produced in CHO cell bioreactor cultures during intentional mycoplasma contamination events. Biotechnol Bioeng. 2020;117(9):2802-2815.
[2] Volokhov DV, Graham LJ, Brorson KA, Chizhikov VE. Mycoplasma testing of cell substrates and biologics: Review of alternative non-microbiological techniques. Mol Cell Probes. 2011 Apr-Jun;25(2-3):69-77.
[3] Ingebritson AL, Gibbs CP, Tong C, Srinivas GB. A PCR detection method for testing Mycoplasma contamination of veterinary vaccines and biological products. Lett Appl Microbiol. 2015 Feb;60(2):174-180.
