双萤光素酶报告基因检测系统~实验操作篇
自1990年萤光素酶生物传感器技术诞生以来,单萤光素酶检测系统到双萤光素酶检测系统的发展,为科研人员提供了更为严谨的实验手段。双萤光素酶报告基因检测系统在单报告基因的基础上引入了“内参对照”报告基因,可以排除不同组之间细胞生长状况、细胞数目以及转染效率带来的干扰,起到校正的作用,从而使实验结果更为可靠。今天小翌将从双萤光素酶报告基因检测系统的原理与应用开篇,给大家分享双萤光素酶报告基因检测系统的实验操作流程。
一
双萤光素酶报告基因检测系统原理
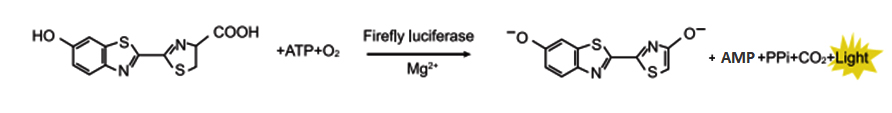
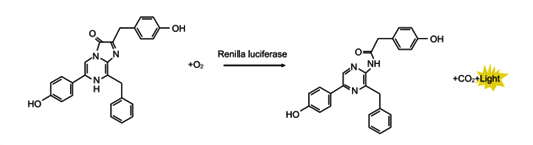
萤火虫萤光素酶是一种胞内蛋白,大小为61KDa。在氧气、ATP和镁离子同时存在的条件下,催化底物萤火虫萤光素氧化,生成氧化萤光素,并发出黄绿色光,其最强发光波长为560nm。
二
双萤光素酶报告基因检测系统应用
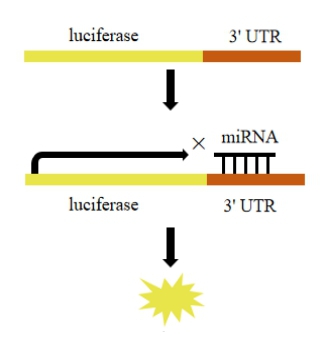
◆ microRNA研究
◆ 转录调控研究
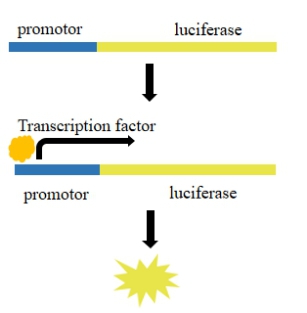
在报告基因的5'端加上待检测基因的启动子,就可以用来检测转录因子对启动子的作用,启动转录越多,那报告基因的表达量就越大,荧光值越高。
◆ 启动子研究
将启动子区域序列进行分段截短,或对特定位点进行突变,再分别构建到luciferase报告载体中,检测其启动子活性。
◆ 信号通路研究
信号通路的激活/监测基因的表达水平。
......
三
双萤光素酶报告基因检测实验操作流程
报告基因检测流程主要有4个模块:分别是质粒构建、细胞转染、报告基因检测和数据分析。
双萤光素酶报告基因系统一般将萤火虫萤光素酶报告基因质粒和海肾萤光素酶报告基因质粒共转染细胞,或将这两个报告基因构建到同一个骨架质粒上(如pGL4质粒),分别用不同的启动子启动其表达。
◆ 主报告基因载体的选择
根据实验目的选择对应的载体骨架。
◆ 内参报告基因载体的选择
带有表达组成型启动子的萤光素酶表达载体作为内参。
◆ 转染细胞系选择
◆ 转染方法选择
◆ 转染报告基因比例
◆ 启动子和转录因子比例
◆ 核酸与转染试剂的比例
从1:2开始调整,另外,注意质粒的纯度、完整度和去内毒素。
◆ 检测试剂选择
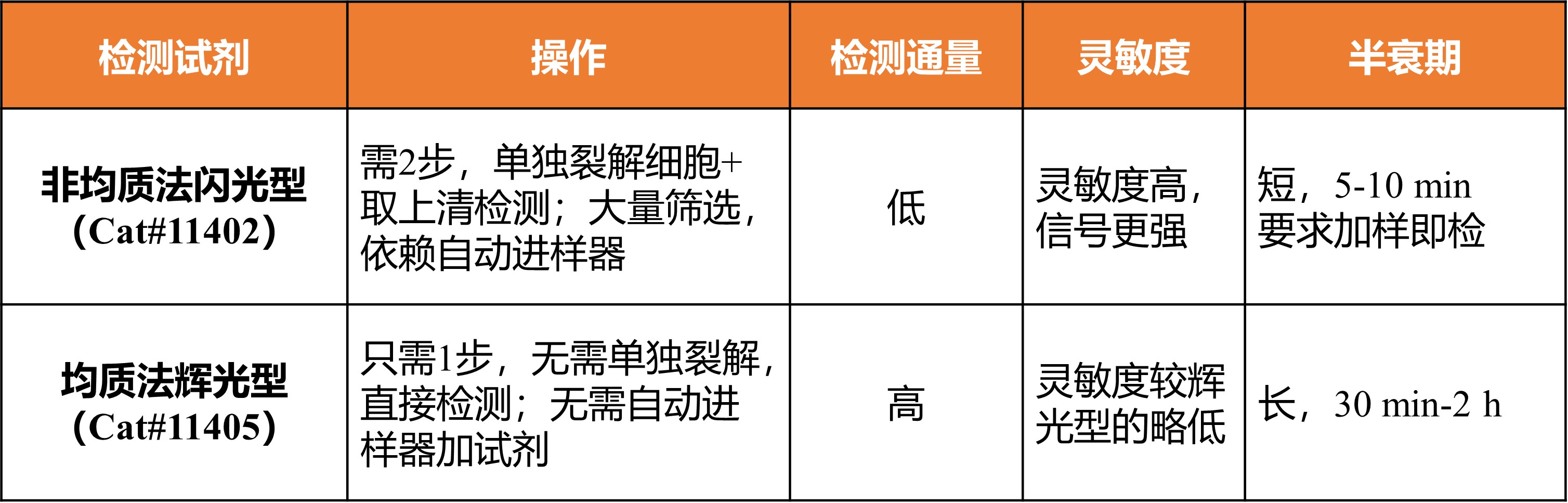
◆ 检测板选择
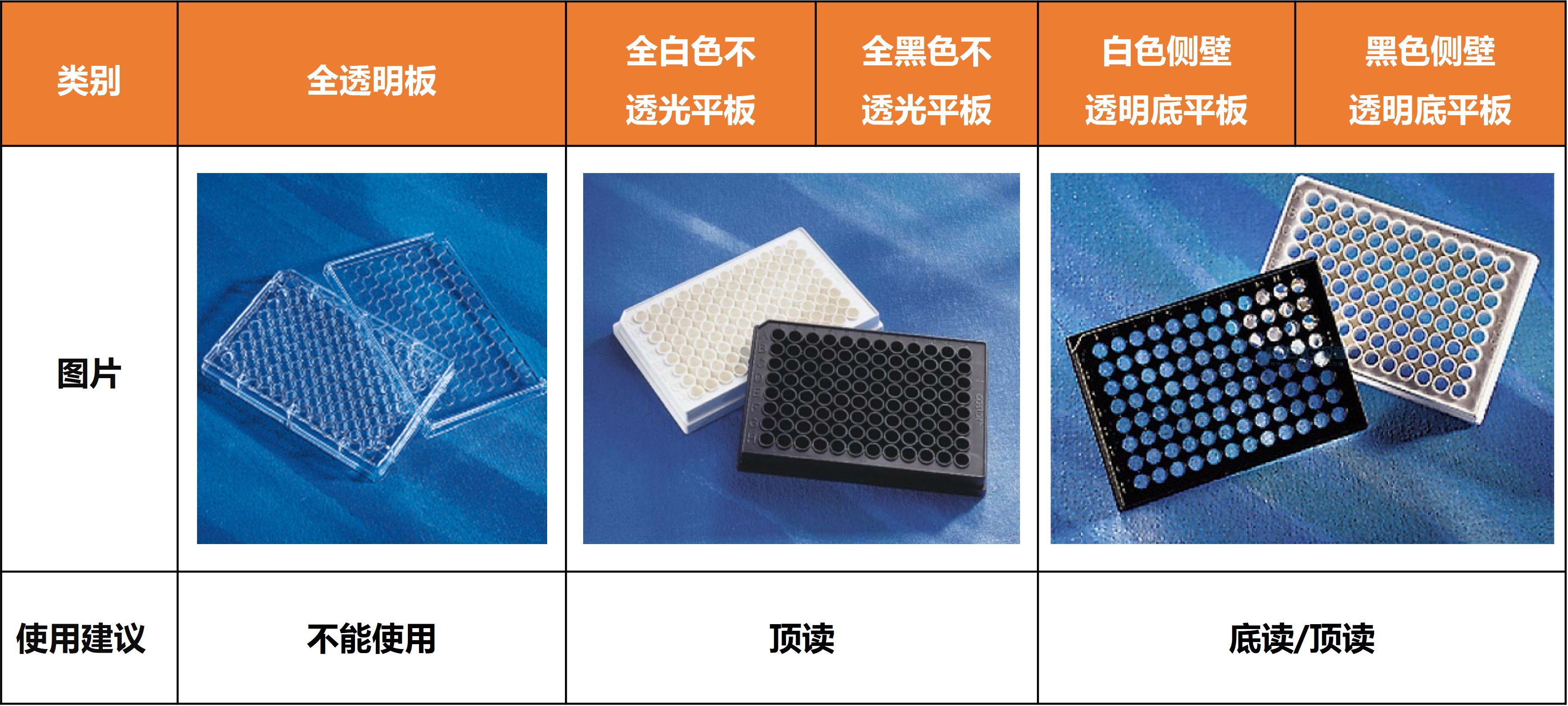
◆ 检测仪器选择
注:只选择在最大波长处检测发光,过滤掉其他发光信号,意味着检测会丢掉很多信号,丢失灵敏度。
检测时间:辉光型0.5-1 sec,闪光型2-10 sec。
通过仪器可以直接读出萤火虫和海肾萤光素酶的数值,两种荧光值读数不少于4位数,读数大于8位数时,需要稀释裂解上清(读数与细胞种类、细胞状态、转染方法、转染时间等因素相关)。
归一化值=萤火虫萤光素酶读值(主报告基因)/海肾萤光素酶读值(内参基因)
相对表达倍数=实验组归一化值/对照组归一化值
给大家举个例子:
|
分类 |
F-Luc |
R-Luc |
归一化(F/R) |
平均值 |
相对表 达倍数 |
|
对照组1 |
20118 |
50201 |
0.400748989 |
0.420043613 |
1 |
|
对照组2 |
18919 |
48091 |
0.393400012 |
||
|
对照组3 |
21910 |
47019 |
0.465981837 |
||
|
实验组1 |
60129 |
60911 |
0.987161596 |
1.226184349 |
2.919183 |
|
实验组2 |
87927 |
56873 |
1.546023596 |
||
|
实验组3 |
78791 |
68791 |
1.145367853 |
下期小翌将会结合大家的留言进一步分享~

相关产品
|
类别 |
产品名称 |
产品货号 |
|
萤光素酶报告基因载体 |
11555ES03 |
|
|
11556ES03 |
||
|
11557ES03 |
||
|
转染试剂 |
40802ES02/03/08 |
|
|
血清 |
40130ES25/76 |
|
|
支原体检测 |
40612ES25/60 |
|
|
单/双萤光素酶报告 基因检测试剂 |
11401ES60/76/80 |
|
|
11402ES10/60/80 |
||
|
11404ES10/60/80 |
||
|
11405ES10/60/80 |
